Hedgehog 信號通路的異常激活與癌癥有關的幾種機制
根據 Hh 信號通路激活后是否依賴 Gli 蛋白發揮生物學效應,Hh 通路激活可以分為兩種不同的途徑:經典以及非典型信號途徑。
經典信號通路激活
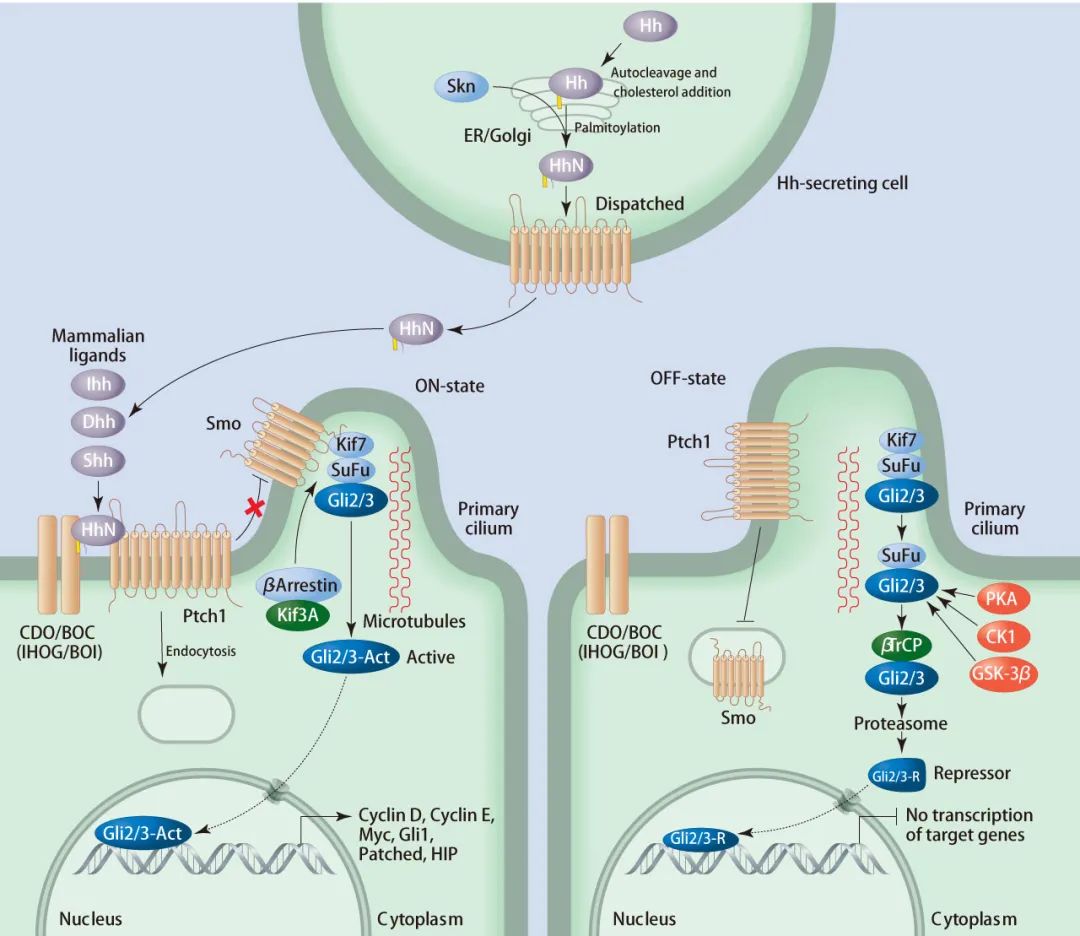
在沒有 Hh 配體的情況下,Hh 受體如 Ptch-1,定位于初級纖毛,可以阻止 SMO 積累且抑制 SMO 活性。蛋白激酶,如 PKA、GSK3β 和 CK1α,磷酸化 GLI2 和 GLI3,導致蛋白體介導全長 Gli 裂解為截短形式 Gli2R、Gli3R,并作為 Hh 靶基因表達的阻遏物。此外,Sufu 通過與細胞質和細胞核中的 Gli 結合,充當該途徑的另一個負調節因子,防止 Hh 靶基因的激活。
在存在 Hh 配體 (如Shh) 的情況下,Hh 配體會與 Ptch-1結合后,Ptch-1 被內化 (Endocytosis),解除對 Smo 的抑制,允許 SMO 的積累和激活,Hh 信號通過由 Kif7、Sufu 和全長 Gli 組成的細胞質蛋白復合物向 Smo 下游傳遞。Smo 移動到初級纖毛的頂端并向 Sufu 發出信號以釋放 Gli 激活劑 (GliA)。然后 GliA 遷移到細胞核并激活靶基因的表達。
圖 1. 經典信號通路激活[8]
左:有 Hh 配體的通路激活 (ON-state);右:無配體的情況 (OFF-state)
非典型信號通路激活
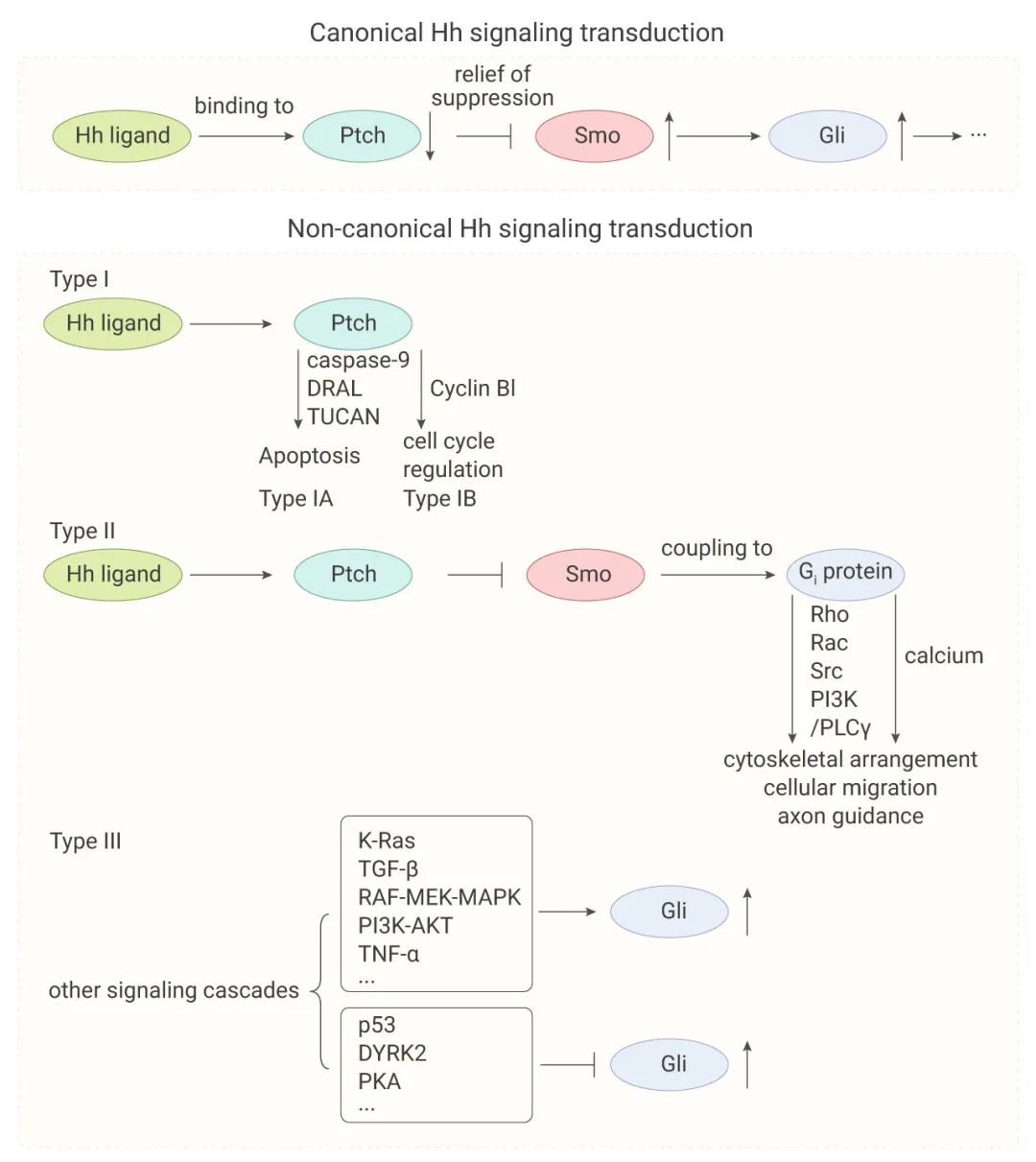
非經典的 Hh 信號轉導是指對 Hh 信號通路的一個或多個組成部分的信號反應,而不是上述 Hh-Ptch-Smo-Gli 經典通路。根據其調節機制,非典型 Hh 信號轉導主要分為三種類型:I 型、II 型和 III 型。
I 型由 Ptch 介導的信號轉導:包括 IA 型 (Ptch 通過募集促凋亡因子如 caspase-9, DRAL, TUCAN 介導細胞凋亡) 和 IB 型 (Ptch 通過與細胞周期蛋白 cyclin B1 相互作用介導的細胞周期調節)。
II 型是 Smo 介導的信號轉導:(依賴 Smo、不依賴 Gli 的 Hh 信號轉導),與 Gi 家族的異源三聚體 G 蛋白偶聯,激活幾種重要的蛋白激酶,包括 Rho、Rac、Src、PI3K/PLCγ,或者第二信使,Smo-Gi 相互作用調節細胞骨架排列、細胞遷移和軸突導向。
III 型是 Gli 介導的 Hh 信號轉導:(即不依賴 Smo、依賴 Gli 的 Hh 信號轉導),Gli 轉錄因子的激活獨立于 Gli 的任何上游信號,如 Hh 配體、Ptch 和 Smo。已經觀察到多種信號級聯,如 K-Ras、TGF-β,RAF-MEK-MAPK、PI3K-AKT 和 TNF-α 參與激活 Gli 活性。
圖 2. 非典型 Hh 通路激活[13]
經典 Hh-Ptch-Smo-Gli 信號通路和 3 種非典型信號通路。
Hh 信號通路與癌癥
正常情況下,成人的 Hh 信號通路在組織中幾乎完全沉默,Hh 信號通路的異常激活可導致癌變。在過去的幾十年里,關于 Hh 信號通路的異常激活與癌癥有關的幾種機制如下分解。
■ I 型突變驅動機制 (不依賴于 Hh 配體機制)
它是指 Hh 信號通路中關鍵成分的突變或擴增 (如抑制性 PTCH 的功能突變喪失或激活 SMO 的功能突變),誘導組成性異常激活,導致腫瘤發生。如約 85% 的散發性基底細胞癌 (BCC) 中發現了 Ptch1 的失活突變,此外在 BCC、髓母細胞瘤和橫紋肌肉瘤中,觀察到功能獲得性 Smo 突變和 (或) 功能喪失性 Sufu 突變。
■ II 型: Hh 配體依賴機制
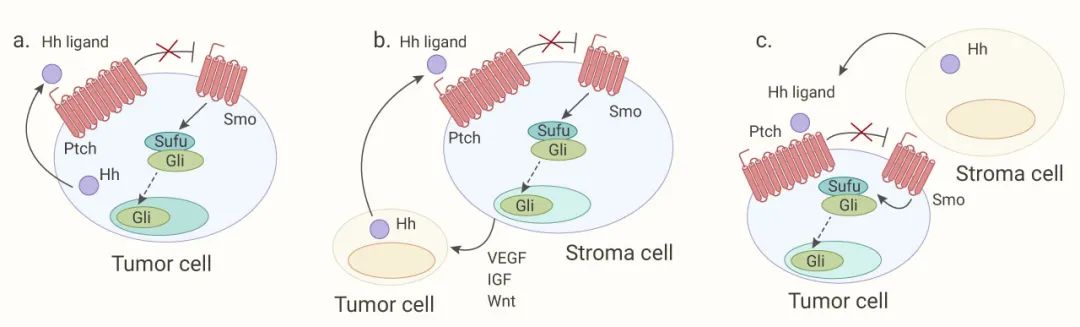
1、自分泌信號:Hh 配體由腫瘤細胞分泌,隨后與 Ptch 結合,并異常激活同一腫瘤細胞中的Hh信號,已在多種腫瘤中發現了配體依賴性自分泌 Hh 信號通路的過表達,包括胃、食管、胰腺、結直腸、卵巢和子宮內膜等。除了 Hh 配體過度表達外,這些腫瘤中的大多數都顯示出 Ptch1 和 Gli 的異位表達。
2、旁分泌信號:腫瘤細胞分泌的 Hh 配體與腫瘤基質細胞上的 Ptch1 受體結合,然后激活 Hh 通路。在反饋回路中,基質細胞將生長信號 (VEGF、IGF、Wnt、PDGF 和 BMP) 傳遞給腫瘤細胞,促進它們增殖和分化。3、反向旁分泌信號:Hh 配體從基質細胞分泌,隨后刺激腫瘤細胞中 Hh 信號通路的激活。
圖 3. II 型 Hh 配體依賴機制[13]
a. 自分泌信號機制;b. 旁分泌信號機制;c. 反向旁分泌信號機制
■ 癌癥干細胞 (CSC) 中 Hh 通路的異常激活
CSCs 由于對常規化學療法和放射療法有潛在的抵抗力,被認為是腫瘤復發的主要原因。CSCs 可響應由相鄰基質細胞、腫瘤細胞或 CSCs 本身分泌的 Hh 配體,通過調節多能性基因 (包括 Nanog、Sox2 和 Bmi1) 來維持干性特征。
靶向 Hh 信號通路
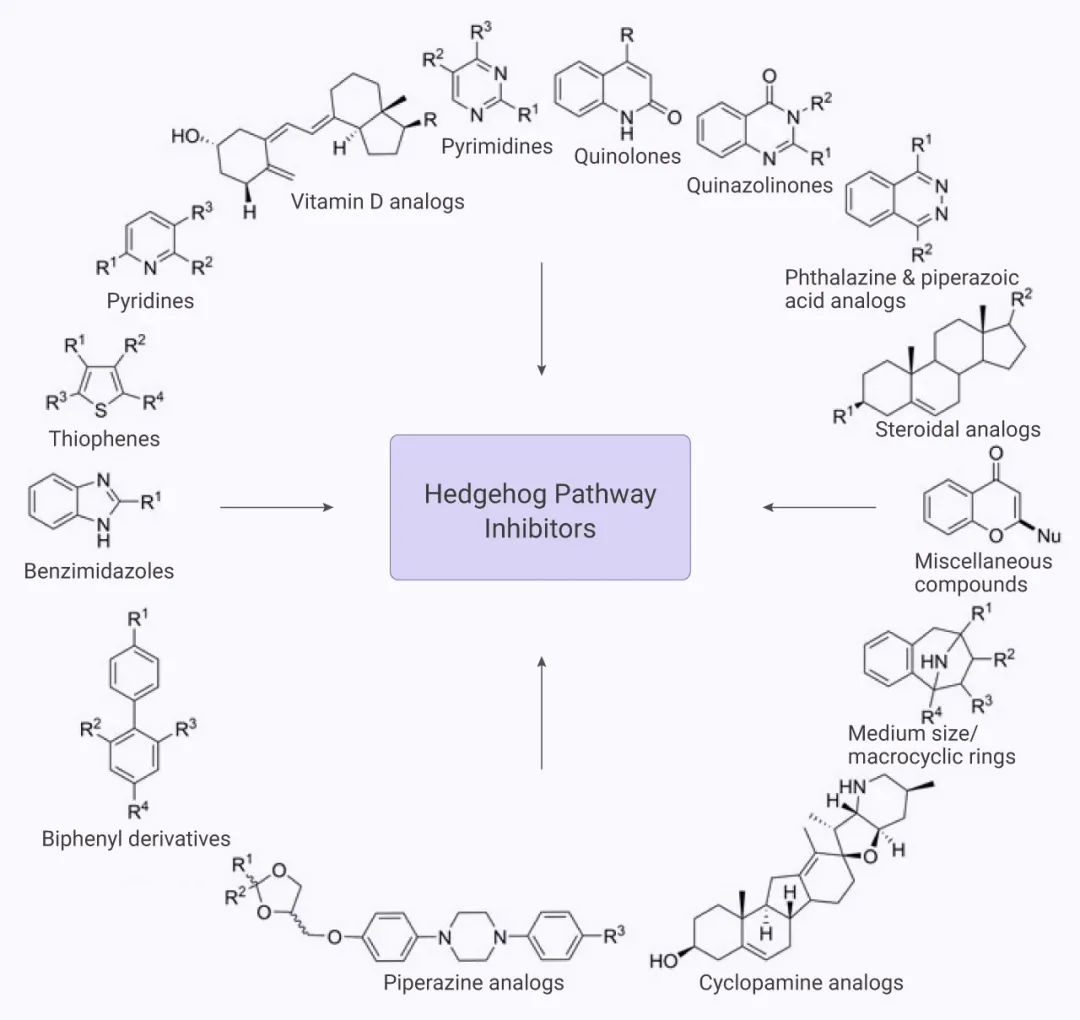
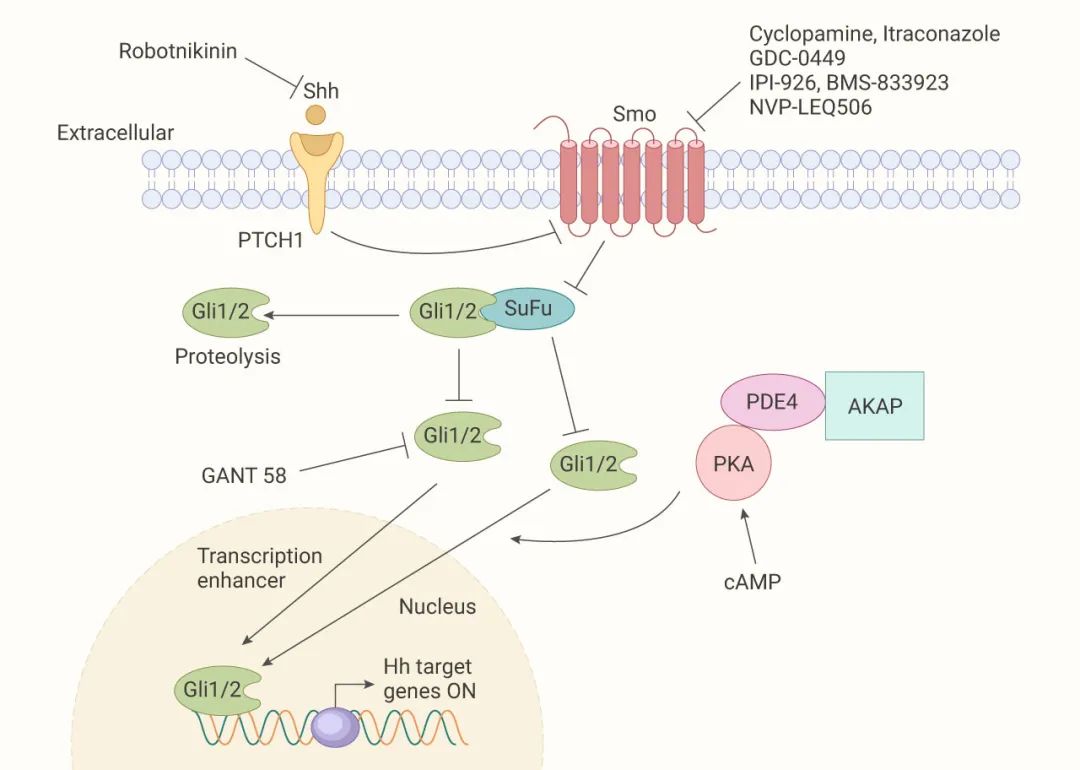
圖 4. 抑制 Hh 途徑的各種化合物[12]
靶向 Hh 途徑的分子結構包括噻吩類、吡啶類、嘧啶類、喹諾酮類、酞嗪類等。
從構效關系看,靶向 Hh 途徑的分子類型如圖 4 所示。從 Hh 途徑看,包括 Smo 上游事件的抑制如 Hh 酰基轉移酶 (Hhat) 抑制劑、SHh 抑制劑;Smo 功能的抑制:Smo 受體拮抗劑/抑制劑;以及 Smo 下游事件的抑制如 Gli 介導的轉錄抑制劑。在這些策略中,直接抑制 Smo 功能一直是最活躍的研究領域,多種 Smo 抑制劑已進入臨床試驗。
圖 5. Hh 途徑部分抑制劑[12]
總結:
Hedgehog (Hh) 信號通路在細胞生長分化、脊椎動物胚胎發育中起重要作用。小 M 簡要介紹了 Hh-Ptch-Smo-Gli 經典通路以及對 Hh 信號通路的一個或多個組成部分的信號反應的非典型通路。對 Hh 信號通路異常激活的癌癥有關的幾種機制進行了分解。
此外,還介紹了該通路的常見抑制劑:目前大多數已知的 Hh 通路拮抗劑靶向 SMO 及其上下游,但 SMO 易受突變影響并產生化學抗性。開發能夠靶向 SMO 下游級聯的化合物代表了一種更有前景的策略。
|
相關產品 |
|
選擇性 Hh 酰基轉移酶 (Hhat) 抑制劑,IC50 為 850 nM;通過獨立于平滑化的非規范信號傳導降低 Gli-1 激活,并抑制 Akt 和 mTOR 通路活性。 |
|
靶向 Hedgehog 通路的 Gli1 和 Gli2 抑制劑,誘導膠質母細胞瘤細胞自噬和凋亡。 |
|
具有口服活性的 SMO 抑制劑;結合到人 SMO (181-787 氨基酸位點),IC50 為 4 nM。 |
|
植物來源的甾體生物堿,通過拮抗 SMO 來 抑制 hedgehog (Hh) 信號通路。 |
|
Hh 通路小分子拮抗劑,可與 SMO 結合,抑制 Hh 通路的異常激活。 |
|
Sonic hedgehog (Shh) 蛋白抑制劑。通過結合 Shh 抑制 Shh 信號通路。 |
MCE 的所有產品僅用作科學研究或藥證申報,我們不為任何個人用途提供產品和服務。
參考文獻
下滑查看更多 ↓
1. Girardi D, et al. Targeting the Hedgehog Pathway in Cancer: Current Evidence and Future Perspectives. Cells. 2019;8(2):153. Published 2019 Feb 12.2. Wilson CW, Chuang PT. Mechanism and evolution of cytosolic Hedgehog signal transduction. Development. 2010;137(13):2079-2094.
3. Yang L, et al. Activation of the hedgehog-signaling pathway in human cancer and the clinical implications. Oncogene. 2010;29(4):469-481.
4. Pietrobono S, Stecca B, et al. Non-canonical Hedgehog Signaling Pathway in Cancer: Activation of GLI Transcription Factors Beyond Smoothened. Front Genet. 2019;10:556. Published 2019 Jun 12.
5. Chen Y, et al. Decoding the phosphorylation code in Hedgehog signal transduction. Cell Res. 2013;23(2):186-200.
6. McMillan R, et al. Molecular pathways: the hedgehog signaling pathway in cancer. Clin Cancer Res. 2012;18(18):4883-4888.
7. Skoda AM, et al. The role of the Hedgehog signaling pathway in cancer: A comprehensive review. Bosn J Basic Med Sci. 2018;18(1):8-20. Published 2018 Feb 20.
8. Ingham PW. Hedgehog signaling. Cold Spring Harb Perspect Biol. 2012;4(6):a011221. Published 2012 Jun 1.
9. Zeng X, Ju D. Hedgehog Signaling Pathway and Autophagy in Cancer. Int J Mol Sci. 2018;19(8):2279. Published 2018 Aug 3.
10. Blotta S, et al. Canonical and noncanonical Hedgehog pathway in the pathogenesis of multiple myeloma. Blood. 2012;120(25):5002-5013.
11. Niyaz M, et al. Hedgehog Signaling: An Achilles' Heel in Cancer. Transl Oncol. 2019;12(10):1334-1344.
12. Bariwal J, et al. Design of Hedgehog pathway inhibitors for cancer treatment. Med Res Rev. 2019;39(3):1137-1204.
13. Xin M, Wang B, et al. Strategies to target the Hedgehog signaling pathway for cancer therapy. Med Res Rev. 2018;38(3):870-913.