超快光化學實現體內低劑量短波紅外成像
研究背景
半導體納米晶體出現在20多年前,作為一種新型造影劑,它突破了傳統染料和熒光蛋白的內在限制。目前,第三代半導體納米晶體在第二個近紅外窗口(NIR-II, 1000 - 1700 nm)發射,克服了可見光探針低穿透深度的限制。在該光譜范圍內,生物組織的吸收和散射系數被降低到最低,允許在大組織深度的活體實現高對比度、高分辨率成像。NIR-II熒光材料改變了臨床前成像領域的游戲規則,使高分辨率解剖成像、腫瘤檢測、生物傳感、腦血管測繪、圖像引導的基因組編輯和手術以及代謝過程的動態跟蹤成為可能。不同于在這個光譜范圍內工作的其他納米探測器,NIR-II發光Ag2S納米晶體不含劇毒重金屬離子,減少生物相容性的擔憂,使其成為目前報道的NIR-II熒光團中最有前途的系統之一。它們的特性已被廣泛應用,包括皮下和經顱測溫、光聲成像和光熱治療的腫瘤治療、早期腫瘤診斷、心臟和心血管系統的動態成像。
為了增強Ag2S點作為NIR-II造影劑的潛力,需對其特性進行大量改進,使其在輻照強度遠低于安全閾值的情況下能進行深層組織成像。現有的Ag2S點由于量子子產率低(QY < 1%)和熒光壽命短(<100ns)而受到熒光亮度低的限制。本研究提出了一種新的方法,允許Ag2S點的QY增加80倍。該過程是基于飛秒激光脈沖照射氯仿分散的Ag2S點,導致形成保護性的AgCl殼。這一殼結構減少了表面陷阱,同時最大限度地減少了非輻射事件的點-介質能量轉移。在這個過程中產生的NPs的亮度優于所有其他現有的NIR-II造影劑。這一改進使得在超低激發強度下的活體全身成像、血管可視化和生物分布跟蹤成為可能。
實驗過程
在合成的Ag2S量子點上利用飛秒激光照射使其生長保護殼,該殼層減少了結構缺陷,使量子產量提高了80倍。PEG化Ag2S超級點能夠在低激發強度(<10 mW cm-2)和劑量(<0.5 mg kg -1)下進行體內深層組織成像,成為NIR-II臨床前生物成像的無與倫比的對比劑。這些結果建立了一種基于化學合成和超快激光處理的協同作用開發超亮NIR-II造影劑的方法。
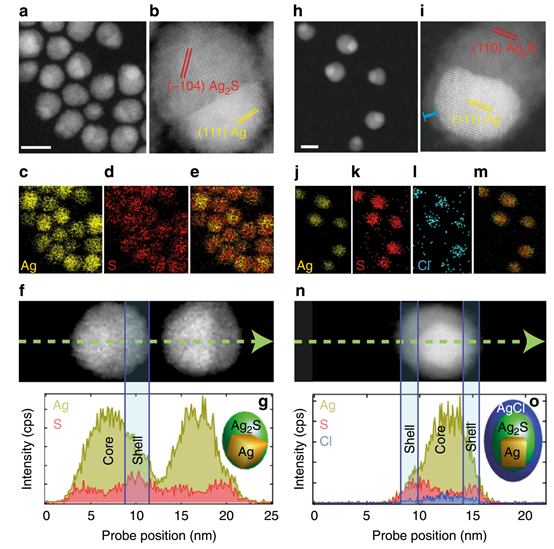
圖1 通過超快激光照射調整結構和化學性質。
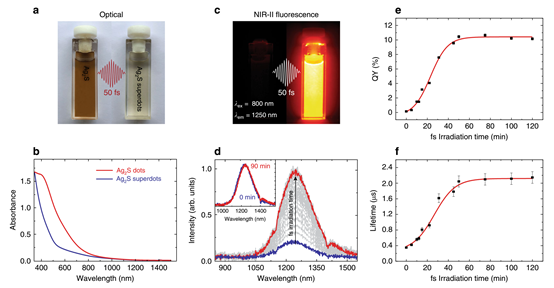
圖2 優化Ag2S從圓點到超級圓點的光學轉換

圖3激光誘導點-超點轉換的條件和機理
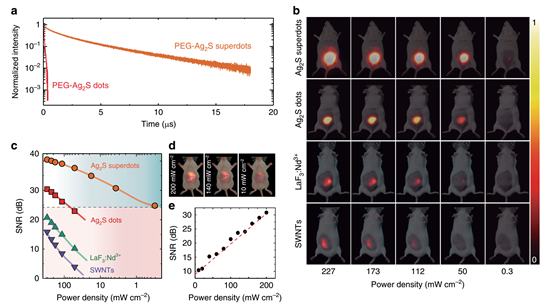
圖4 Ag2S超點的體內亮度:與其競爭對手的比較。

研究小結
盡管Ag2S點作為NIR-II光學探針表現出了優異的性能,但其潛在的臨床前應用受到其低亮度的限制。傳統的合成路線會導致QY通常低于1%的Ag2S點。飛秒激光脈沖可以將這個QY提高一個數量級以上,高達10%以上(圖2e),而不會影響以1200 nm為中心的寬帶發射的光譜形狀。飛秒激光脈沖觸發的dot-to-superdot轉換與實驗條件密切相關。它需要銀NPs和氯仿分子的存在(圖3b, c)。大于100 fs的脈沖寬度會導致緩慢和低效的點到超級點的轉換(圖3d)。本研究得出結論,點到超點的轉變是一個連續的過程(圖3e):(i)飛秒激光脈沖誘導銀NPs的庫侖爆炸,(ii)銀原子與溶劑分子發生反應,(iii) AgCl保護殼包圍Ag2S點。這種保護外殼(由電子顯微鏡證明,圖1)大大減少了表面相關的非輻射過程,并導致亮度增加和更長的熒光壽命(圖2f)。超快激光脈沖的能力可以改善NPs的發光性能,這一發現刺激了新的合成程序的發展,將促進傳統化學路線和光物質相互作用過程的協同作用。
參考文獻:Santos, Harrisson D. A. , et al. "Ultrafast photochemistry produces superbright short-wave infrared dots for low-dose in vivo imaging." Nature Communications (2020).





