DRIP-seq揭示AMPK通過R-loop形成以維持基因組穩定和生殖細胞完整
在饑餓等能量脅迫條件下,生物體會通過調整基因表達和代謝來適應。AMPK(AMP激活蛋白激酶)是一種高度保守的代謝主調控因子,能夠感知能量水平的降低,并在饑餓等應激條件下合理分配能量。秀麗隱桿線蟲(Caenorhabditis elegans,C. elegans)在胚胎發育結束后,如果營養充足則繼續發育;如果缺乏食物,則進入一種靜止的非發育狀態(L1滯育期),細胞分裂暫停,轉錄和翻譯維持在最低水平。研究者之前發現,缺乏AMPK的線蟲在從急性饑餓中恢復后,會出現生殖缺陷,且這些缺陷會傳遞到未經歷饑餓的后代中。那么秀麗隱桿線蟲在饑餓條件下,AMPK缺失是如何導致表觀遺傳修飾異常、基因組不穩定性以及生殖缺陷的呢?
近日,加拿大麥吉爾大學生物系Bing Sun、McLean Sherrin、Richard Roy揭示了AMPK缺失導致的異常表觀遺傳修飾(特別是組蛋白H3K4me3的異常沉積)如何通過形成異常的R-loop結構(RNA-DNA雜合體)影響基因組穩定性,并導致生殖缺陷。還探討了這些表觀遺傳修飾和R-loop的跨代遺傳性,以及它們對生殖細胞完整性和DNA損傷響應的影響。相關研究成果以“Unscheduled epigenetic modifications cause genome instability and sterility through aberrant R-loops following starvation”為題發表于《Nucleic Acids Research》(NAR)期刊。

標題:Unscheduled epigenetic modifications cause genome instability and sterility through aberrant R-loops following starvation(饑餓后,異常的的表觀遺傳修飾通過異常的R-loop結構導致基因組不穩定性和不育)
發表時間:2023-1-11
發表期刊:Nucleic Acids Research
影響因子:IF 16.6 / 1區
技術平臺:ChIP-seq、DRIP-seq
在饑餓期間,生物體會調整基因表達和代謝以適應能量脅迫。作者先前研究表明,AMP激活蛋白激酶(AMPK)缺乏的秀麗隱桿線蟲在從急性饑餓中恢復后,其生殖細胞中組蛋白H3在第4位賴氨酸上三甲基化(H3K4me3)水平異常升高,并表現出跨代生殖缺陷。本研究進一步發現,這些H3K4me3修飾在啟動子區域顯著增加,驅動異常的轉錄延伸,導致饑餓的AMPK突變體中R-loop結構積累。
作者通過DNA-RNA免疫沉淀高通量測序(DRIP-seq)分析發現基因組中有相當一部分區域受R-loop形成影響,尤其在染色質被H3K4me3修飾的基因啟動子-轉錄起始位點區域影響最為顯著。與H3K4me3類似,R-loop也具有可遺傳性,可能促進了這些突變體在饑餓后典型的跨代生殖缺陷。此外,AMPK突變體的生殖細胞在R-loop形成位點顯示出顯著更多的RAD-51(一種RecA類重組酶)焦點,這可能會限制它們在減數分裂斷裂或誘導性DNA損傷位點的正常功能。
本研究揭示了AMPK在饑餓后維持基因組穩定性中的重要作用。R-loop對DNA損傷敏感性和生殖干細胞完整性的下游影響,可能解釋了在許多人類疾病(包括各種癌癥)中發生的異常表觀遺傳修飾。
研究方法
實驗模型:使用秀麗隱桿線蟲(C. elegans),特別是缺乏AMPK的突變體(aak-1/2)。
實驗設計:將線蟲置于饑餓條件下(M9緩沖液中3天),然后恢復營養供應,觀察其生殖和基因組變化。
技術手段:
ChIP-seq(染色質免疫沉淀測序):用于分析H3K4me3在基因組中的分布。
DRIP-seq(DNA-RNA免疫沉淀測序):用于檢測R-loop的形成和分布。
免疫熒光:檢測R-loop和RAD-51(一種DNA修復蛋白)的定位。
藥物處理和基因過表達:通過抑制轉錄延伸或過表達RNH-1(RNA酶H同源物)來研究R-loop的形成機制。
基因表達分析:通過4sU標記和qPCR驗證R-loop的形成與轉錄活性的關系。
關鍵發現
(1)H3K4me3的異常沉積
在饑餓條件下,AMPK缺失的線蟲中,H3K4me3在基因啟動子和轉錄起始位點(TSS)區域顯著增加,這種異常沉積可跨代遺傳。此外,這些異常的H3K4me3位點與RNA聚合酶II(Pol II)的轉錄延伸活性相關,表明它們可能激活了本應沉默的基因。
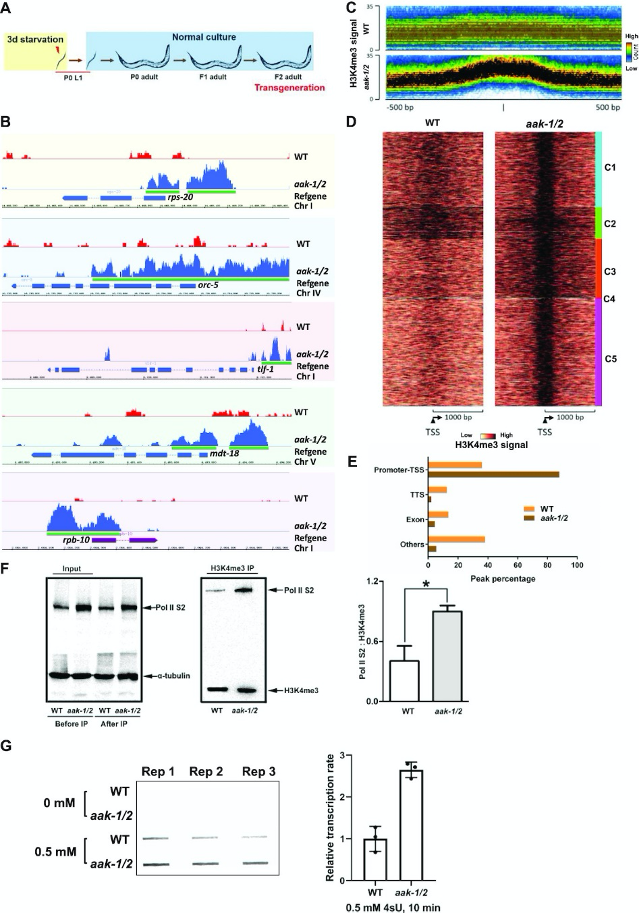
圖1. 饑餓的AMPK突變體后代中,異常的H3K4me3沉積主要發生在TSS區域。
A. H3K4me3 ChIP-seq分析的樣本收集方案。 P0代L1滯育期動物在M9緩沖液中饑餓3天,隨后讓幼蟲進食直至收集F2代成蟲。
B. H3K4me3 ChIP-seq信號在rps-20、orc-5、tlf-1、mdt-18和rpb-10基因的啟動子-TSS區域的基因組瀏覽器快照。綠條表示啟動子-TSS區域的H3K4me3信號peaks。軌跡高度代表測序reads數。
C. 野生型(WT)與AMPK突變體在TSS處的H3K4me3信號的線性軌跡。
D. WT和aak-1/2動物在TSS處的H3K4me3信號的k均值聚類熱圖。
E. H3K4me3 peaks的注釋和定位分析。 分析了比對到啟動子-TSS、轉錄終止位點(TTS)、外顯子和其他區域的H3K4me3 peaks。在aak-1/2突變體中,peaks主要累積在啟動子-TSS區域。
F. 饑餓的AMPK突變體中異常的H3K4me3位點參與轉錄。 在L1滯育后的野生型(N2)和AMPK突變體F2成蟲中進行抗H3K4me3的ChIP實驗。
G. 饑餓的AMPK突變體中活躍轉錄水平更高。 使用4sU標記法評估饑餓的AMPK突變體L1幼蟲的F2代后代中的活躍轉錄,同時處理的野生型對照組也進行了類似分析(左圖)。在10分鐘脈沖標記后評估并定量了4sU的摻入率(右圖)。
(2)R-loop的形成與積累:
在饑餓條件下,AMPK缺失的線蟲生殖細胞中R-loop顯著增加,尤其是在啟動子-TSS區域。R-loop的形成與H3K4me3的異常沉積相關,且這種R-loop增加可以傳遞到后代中。通過RNH-1過表達或抑制轉錄延伸,可以減少R-loop的形成,并部分恢復線蟲的生育能力。

圖2:R-loop在饑餓的AMPK突變體生殖細胞中積累。
A. 饑餓后的AMPK突變體(P0代)的生殖表型并非由蛋白質合成時機不當引起。上圖:野生型(WT)和aak-1/2幼蟲在含有CHX(濃度如圖所示)的M9緩沖液中維持3天后,轉移至營養充足的培養基中。圖中顯示的是成蟲的可育比例,樣本量n≥150。下圖:在饑餓期間用CHX處理的AMPK突變體后代(F1和F2代)中,繁殖力缺陷并未得到恢復。圖中顯示的是aak-1/2突變體及其后代(F1和F2代)中繁殖力降低的頻率,樣本量n≥50。
B. R-loop在AMPK突變體的生殖細胞中積累。代表性顯微照片顯示了饑餓的AMPK突變體和WT年輕成蟲生殖細胞中的R-loop。thoc-2突變體的生殖細胞作為R-loop檢測的陽性對照。WT和aak-1/2的L1幼蟲饑餓3天后轉移至營養充足的條件下。生殖細胞經固定后,用S9.6抗體(紅色,標記R-loop)進行免疫染色,并用DAPI(藍色)進行復染。圖中框出的部分在下方以更高倍率顯示(N=3,n=100)。星號(*)表示遠端尖細胞;比例尺:5μm。右側圖:通過免疫熒光定量分析顯示,饑餓的AMPK突變體生殖細胞中R-loop的總體豐度顯著增加;n=100。
C. R-loop在AMPK突變體的原始生殖細胞(PGC)中形成,并在表達RNH-1后得以緩解。WT和aak-1/2的L1幼蟲饑餓3天后,用S9.6抗體(綠色,標記R-loop)進行免疫染色,并用生殖細胞特異性標記物HIM-3同源物(HTP)-3(紅色)進行復染。類似地,表達生殖細胞特異性RNH-1轉基因(pie-1p::rnh-1)的饑餓突變體動物的R-loop水平與對照組相似。每種基因型的PGC中R-loop水平被定量并以圖形顯示。白色箭頭表示PGC(注意饑餓的AMPK突變體有額外的PGC)。
D. R-loop在AMPK突變體中隨著后代延續逐漸減少。通過免疫熒光使用S9.6抗體(紅色,標記R-loop)和DAPI(藍色)復染,檢測P0(n=83)、F2(n=100)和F5(n=81)成蟲生殖細胞核中的DNA-RNA雜合體。白色箭頭表示R-loop(S9.6)焦點。P0(n=83)、F2(n=100)和F5(n=81)通過S9.6抗體進行免疫熒光分析。
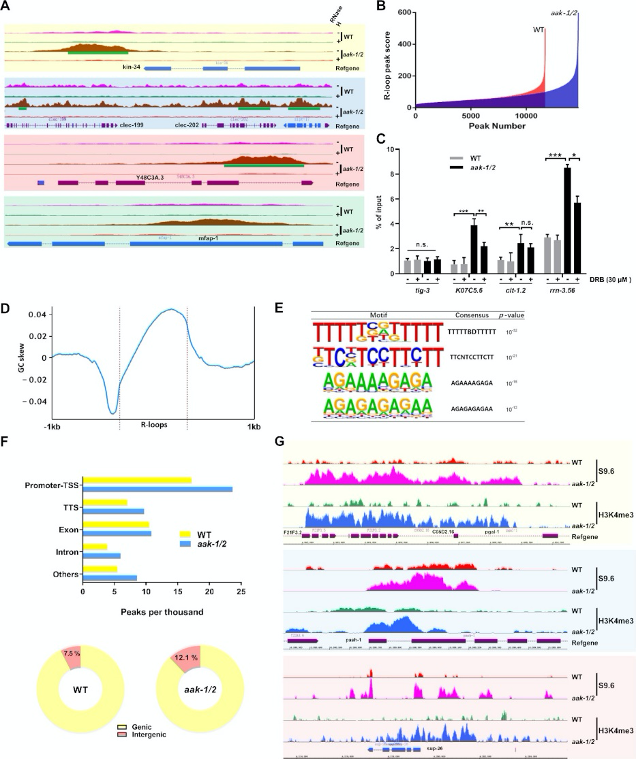
B. 野生型(WT)與aak-1/2基因組的DRIP-seq output(peak分數和數量)的整體比較。
C. DRIP-qPCR驗證。 收集了經過或未經DRB處理的饑餓的aak-1/2突變體的F2后代(饑餓3天)進行DRIP分析。選擇tig-3作為陰性對照;n=3,均值±標準誤(S.E.M.)。以input基因組DNA為基準進行信號值歸一化并繪制。
D. 以所有R-loop peaks為中心的GC偏好Meta圖。
E. 通過HOMER分析AMPK突變體與WT DRIP-seq鑒定的四個富集的de novo motif。
F. 上:注釋和R-loop peaks定位分析,顯示peaks比對到啟動子-TSS、轉錄終止位點(TTS)、外顯子、內含子和其他區域。在aak-1/2突變體中,peaks主要累積在啟動子-TSS區域。
G. 下:WT或饑餓aak-1/2突變體F2后代DRIP-seq信號分布餅圖,顯示基因內與基因間區域分布。
H. 基因組瀏覽器快照顯示饑餓的AMPK突變體F2后代中R-loop信號與H3K4me3水平正相關的代表性樣本。
(3)RAD-51異常積累與DNA損傷:
AMPK缺失的線蟲生殖細胞中,RAD-51焦點顯著增加,且與R-loop共定位。這些異常的RAD-51焦點可能與R-loop引起的DNA損傷相關,導致生殖細胞的凋亡增加。在缺乏p53信號通路的線蟲中,生殖細胞凋亡減少,但胚胎致死率增加,表明DNA損傷未被修復。
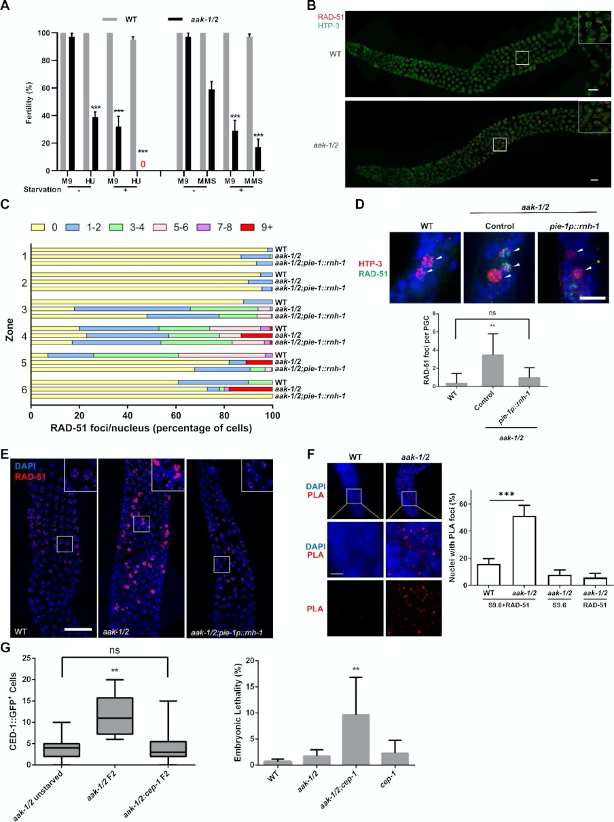
圖4. 饑餓導致AMPK突變體中RAD-51異常聚集到與R-loop相關的位點。
A. AMPK突變體L1幼蟲對基因毒性應激敏感,并在饑餓后變得超敏感。饑餓或進食4小時的L1幼蟲被暴露于25 mM HU和0.01% MMS中,這些濃度低于之前確定的導致野生型(WT)動物不育的閾值(48)。
B. 饑餓的AMPK突變體生殖細胞中RAD-51焦點異常增加。
C. RAD-51焦點的數量和出現時間在生殖細胞的六個區域中的定量分析:有絲分裂區、過渡區、早中期偶線期、中期偶線期、晚中期偶線期和雙線期,n>5。
D. 代表性顯微照片顯示3天饑餓的L1幼蟲原始生殖細胞(PGC)中的RAD-51焦點。
E. 免疫熒光顯微照片顯示饑餓的WT、aak-1/2突變體以及aak-1/2;pie-1p::rnh-1轉基因線蟲的年輕成蟲生殖細胞晚中期偶線期區域中的RAD-51焦點。
F. 饑餓的AMPK突變體F2后代生殖細胞中異常豐富的RAD-51信號與R-loop重疊。上圖:PLA信號以紅色斑點表示。星號(*)表示遠端尖細胞。下圖:每條生殖腺中帶有PLA焦點的細胞核的百分比定量分析。顯示AMPK突變體生殖腺的單抗體對照;n=5。
G. 左圖:饑餓的WT與AMPK突變體生殖腺中增加的細胞死亡依賴于DNA損傷。通過計數生殖腺臂中異常細胞死亡(CED)-1::GFP陽性細胞來定量凋亡小體。箱線圖顯示組內平均值、50%范圍和最小到最大值,n=25。右圖:去除cep-1信號通路會增加饑餓的WT與AMPK突變體生殖腺中的胚胎致死率。定量分析之前饑餓的指定基因型動物F2后代中的胚胎致死率。樣本數量:WT,n=10;aak-1(tm1844) I,aak-2(ok524) X,n=10;aak-1(tm1844) I,aak-2(ok524)X;cep-1(gk138) I,n=20;cep-1(gk138) I,n=20。
(4)跨代遺傳的生殖缺陷:
AMPK缺失導致的異常H3K4me3和R-loop的形成不僅影響當前代,還會傳遞到未經歷饑餓的后代中,導致生殖缺陷逐漸加劇。這些表觀遺傳修飾和R-loop跨代傳遞可能通過生殖細胞中的“分子記憶”實現。
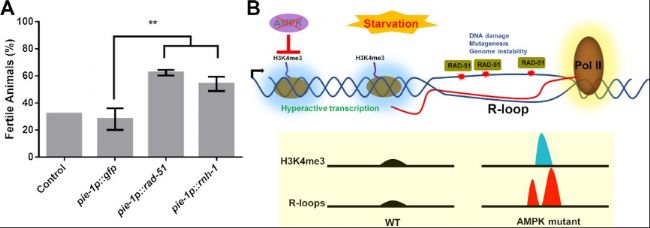 圖5. R-loop位點上的RAD-51隔離限制了其在減數分裂中的可用性,導致饑餓依賴性生殖缺陷。
圖5. R-loop位點上的RAD-51隔離限制了其在減數分裂中的可用性,導致饑餓依賴性生殖缺陷。
A. pie-1p::rad-51的多拷貝陣列可以部分恢復AMPK突變體在饑餓后的生殖能力。轉基因L1幼蟲在20°C下于M9緩沖液中維持72小時,隨后恢復到營養充足條件下。在恢復后96小時評估生育百分比。
B. 模型展示了在急性饑餓期間發生的AMPK依賴性事件。AMPK限制了異常的H3K4me3沉積及其隨后導致的轉錄,這種轉錄增加了R-loop的形成和基因組不穩定性。
易小結:
本研究揭示了AMPK在饑餓條件下通過調控H3K4me3沉積和R-loop形成來維持基因組穩定性和生殖細胞完整性的機制。AMPK缺失導致的異常表觀遺傳修飾和R-loop積累不僅影響當前代,還會跨代傳遞,導致生殖缺陷和基因組不穩定性。這些發現為理解環境應激與表觀遺傳修飾之間的關系提供了新的見解,并可能對人類生殖健康和癌癥研究產生重要影響。
本研究的重要意義
ChIP-seq和DRIP-seq在本研究中的作用
DRIP-seq(DNA-RNA免疫沉淀測序)和ChIP-seq(染色質免疫沉淀測序)是兩種關鍵的高通通量測序技術,分別用于研究R-loop的形成和組蛋白修飾的分布, DRIP-seq和ChIP-seq在本研究中共同揭示了AMPK缺失如何通過H3K4me3的異常沉積導致R-loop的形成,進而引發基因組不穩定性。
DRIP-seq專注于R-loop的全基因組分布及其與轉錄活性的關系,而ChIP-seq則專注于H3K4me3修飾的分布及其對轉錄調控的影響。
兩種技術的結合為理解AMPK在維持基因組穩定性中的作用提供了全面的視角,并揭示了表觀遺傳修飾異常如何導致跨代生殖缺陷和基因組不穩定性。
參考文獻:
Sun B, Sherrin M, Roy R. Unscheduled epigenetic modifications cause genome instability and sterility through aberrant R-loops following starvation. Nucleic Acids Res. 2023 Jan 11;51(1):84-98. pii: 6887602. doi: 10.1093/nar/gkac1155.
近日,加拿大麥吉爾大學生物系Bing Sun、McLean Sherrin、Richard Roy揭示了AMPK缺失導致的異常表觀遺傳修飾(特別是組蛋白H3K4me3的異常沉積)如何通過形成異常的R-loop結構(RNA-DNA雜合體)影響基因組穩定性,并導致生殖缺陷。還探討了這些表觀遺傳修飾和R-loop的跨代遺傳性,以及它們對生殖細胞完整性和DNA損傷響應的影響。相關研究成果以“Unscheduled epigenetic modifications cause genome instability and sterility through aberrant R-loops following starvation”為題發表于《Nucleic Acids Research》(NAR)期刊。

標題:Unscheduled epigenetic modifications cause genome instability and sterility through aberrant R-loops following starvation(饑餓后,異常的的表觀遺傳修飾通過異常的R-loop結構導致基因組不穩定性和不育)
發表時間:2023-1-11
發表期刊:Nucleic Acids Research
影響因子:IF 16.6 / 1區
技術平臺:ChIP-seq、DRIP-seq
在饑餓期間,生物體會調整基因表達和代謝以適應能量脅迫。作者先前研究表明,AMP激活蛋白激酶(AMPK)缺乏的秀麗隱桿線蟲在從急性饑餓中恢復后,其生殖細胞中組蛋白H3在第4位賴氨酸上三甲基化(H3K4me3)水平異常升高,并表現出跨代生殖缺陷。本研究進一步發現,這些H3K4me3修飾在啟動子區域顯著增加,驅動異常的轉錄延伸,導致饑餓的AMPK突變體中R-loop結構積累。
作者通過DNA-RNA免疫沉淀高通量測序(DRIP-seq)分析發現基因組中有相當一部分區域受R-loop形成影響,尤其在染色質被H3K4me3修飾的基因啟動子-轉錄起始位點區域影響最為顯著。與H3K4me3類似,R-loop也具有可遺傳性,可能促進了這些突變體在饑餓后典型的跨代生殖缺陷。此外,AMPK突變體的生殖細胞在R-loop形成位點顯示出顯著更多的RAD-51(一種RecA類重組酶)焦點,這可能會限制它們在減數分裂斷裂或誘導性DNA損傷位點的正常功能。
本研究揭示了AMPK在饑餓后維持基因組穩定性中的重要作用。R-loop對DNA損傷敏感性和生殖干細胞完整性的下游影響,可能解釋了在許多人類疾病(包括各種癌癥)中發生的異常表觀遺傳修飾。
研究方法
實驗模型:使用秀麗隱桿線蟲(C. elegans),特別是缺乏AMPK的突變體(aak-1/2)。
實驗設計:將線蟲置于饑餓條件下(M9緩沖液中3天),然后恢復營養供應,觀察其生殖和基因組變化。
技術手段:
ChIP-seq(染色質免疫沉淀測序):用于分析H3K4me3在基因組中的分布。
DRIP-seq(DNA-RNA免疫沉淀測序):用于檢測R-loop的形成和分布。
免疫熒光:檢測R-loop和RAD-51(一種DNA修復蛋白)的定位。
藥物處理和基因過表達:通過抑制轉錄延伸或過表達RNH-1(RNA酶H同源物)來研究R-loop的形成機制。
基因表達分析:通過4sU標記和qPCR驗證R-loop的形成與轉錄活性的關系。
關鍵發現
(1)H3K4me3的異常沉積
在饑餓條件下,AMPK缺失的線蟲中,H3K4me3在基因啟動子和轉錄起始位點(TSS)區域顯著增加,這種異常沉積可跨代遺傳。此外,這些異常的H3K4me3位點與RNA聚合酶II(Pol II)的轉錄延伸活性相關,表明它們可能激活了本應沉默的基因。

圖1. 饑餓的AMPK突變體后代中,異常的H3K4me3沉積主要發生在TSS區域。
B. H3K4me3 ChIP-seq信號在rps-20、orc-5、tlf-1、mdt-18和rpb-10基因的啟動子-TSS區域的基因組瀏覽器快照。綠條表示啟動子-TSS區域的H3K4me3信號peaks。軌跡高度代表測序reads數。
C. 野生型(WT)與AMPK突變體在TSS處的H3K4me3信號的線性軌跡。
D. WT和aak-1/2動物在TSS處的H3K4me3信號的k均值聚類熱圖。
E. H3K4me3 peaks的注釋和定位分析。 分析了比對到啟動子-TSS、轉錄終止位點(TTS)、外顯子和其他區域的H3K4me3 peaks。在aak-1/2突變體中,peaks主要累積在啟動子-TSS區域。
F. 饑餓的AMPK突變體中異常的H3K4me3位點參與轉錄。 在L1滯育后的野生型(N2)和AMPK突變體F2成蟲中進行抗H3K4me3的ChIP實驗。
G. 饑餓的AMPK突變體中活躍轉錄水平更高。 使用4sU標記法評估饑餓的AMPK突變體L1幼蟲的F2代后代中的活躍轉錄,同時處理的野生型對照組也進行了類似分析(左圖)。在10分鐘脈沖標記后評估并定量了4sU的摻入率(右圖)。
(2)R-loop的形成與積累:
在饑餓條件下,AMPK缺失的線蟲生殖細胞中R-loop顯著增加,尤其是在啟動子-TSS區域。R-loop的形成與H3K4me3的異常沉積相關,且這種R-loop增加可以傳遞到后代中。通過RNH-1過表達或抑制轉錄延伸,可以減少R-loop的形成,并部分恢復線蟲的生育能力。

圖2:R-loop在饑餓的AMPK突變體生殖細胞中積累。
B. R-loop在AMPK突變體的生殖細胞中積累。代表性顯微照片顯示了饑餓的AMPK突變體和WT年輕成蟲生殖細胞中的R-loop。thoc-2突變體的生殖細胞作為R-loop檢測的陽性對照。WT和aak-1/2的L1幼蟲饑餓3天后轉移至營養充足的條件下。生殖細胞經固定后,用S9.6抗體(紅色,標記R-loop)進行免疫染色,并用DAPI(藍色)進行復染。圖中框出的部分在下方以更高倍率顯示(N=3,n=100)。星號(*)表示遠端尖細胞;比例尺:5μm。右側圖:通過免疫熒光定量分析顯示,饑餓的AMPK突變體生殖細胞中R-loop的總體豐度顯著增加;n=100。
C. R-loop在AMPK突變體的原始生殖細胞(PGC)中形成,并在表達RNH-1后得以緩解。WT和aak-1/2的L1幼蟲饑餓3天后,用S9.6抗體(綠色,標記R-loop)進行免疫染色,并用生殖細胞特異性標記物HIM-3同源物(HTP)-3(紅色)進行復染。類似地,表達生殖細胞特異性RNH-1轉基因(pie-1p::rnh-1)的饑餓突變體動物的R-loop水平與對照組相似。每種基因型的PGC中R-loop水平被定量并以圖形顯示。白色箭頭表示PGC(注意饑餓的AMPK突變體有額外的PGC)。
D. R-loop在AMPK突變體中隨著后代延續逐漸減少。通過免疫熒光使用S9.6抗體(紅色,標記R-loop)和DAPI(藍色)復染,檢測P0(n=83)、F2(n=100)和F5(n=81)成蟲生殖細胞核中的DNA-RNA雜合體。白色箭頭表示R-loop(S9.6)焦點。P0(n=83)、F2(n=100)和F5(n=81)通過S9.6抗體進行免疫熒光分析。

圖3. R-loop形成與H3K4me3異位沉積相關。
A. 基因組瀏覽器快照顯示基因鄰近區域和RNH軌跡的DRIP-seq信號。 綠色條表示R-loop peaks calling。軌跡高度代表reads數。B. 野生型(WT)與aak-1/2基因組的DRIP-seq output(peak分數和數量)的整體比較。
C. DRIP-qPCR驗證。 收集了經過或未經DRB處理的饑餓的aak-1/2突變體的F2后代(饑餓3天)進行DRIP分析。選擇tig-3作為陰性對照;n=3,均值±標準誤(S.E.M.)。以input基因組DNA為基準進行信號值歸一化并繪制。
D. 以所有R-loop peaks為中心的GC偏好Meta圖。
E. 通過HOMER分析AMPK突變體與WT DRIP-seq鑒定的四個富集的de novo motif。
F. 上:注釋和R-loop peaks定位分析,顯示peaks比對到啟動子-TSS、轉錄終止位點(TTS)、外顯子、內含子和其他區域。在aak-1/2突變體中,peaks主要累積在啟動子-TSS區域。
G. 下:WT或饑餓aak-1/2突變體F2后代DRIP-seq信號分布餅圖,顯示基因內與基因間區域分布。
H. 基因組瀏覽器快照顯示饑餓的AMPK突變體F2后代中R-loop信號與H3K4me3水平正相關的代表性樣本。
(3)RAD-51異常積累與DNA損傷:
AMPK缺失的線蟲生殖細胞中,RAD-51焦點顯著增加,且與R-loop共定位。這些異常的RAD-51焦點可能與R-loop引起的DNA損傷相關,導致生殖細胞的凋亡增加。在缺乏p53信號通路的線蟲中,生殖細胞凋亡減少,但胚胎致死率增加,表明DNA損傷未被修復。

圖4. 饑餓導致AMPK突變體中RAD-51異常聚集到與R-loop相關的位點。
B. 饑餓的AMPK突變體生殖細胞中RAD-51焦點異常增加。
C. RAD-51焦點的數量和出現時間在生殖細胞的六個區域中的定量分析:有絲分裂區、過渡區、早中期偶線期、中期偶線期、晚中期偶線期和雙線期,n>5。
D. 代表性顯微照片顯示3天饑餓的L1幼蟲原始生殖細胞(PGC)中的RAD-51焦點。
E. 免疫熒光顯微照片顯示饑餓的WT、aak-1/2突變體以及aak-1/2;pie-1p::rnh-1轉基因線蟲的年輕成蟲生殖細胞晚中期偶線期區域中的RAD-51焦點。
F. 饑餓的AMPK突變體F2后代生殖細胞中異常豐富的RAD-51信號與R-loop重疊。上圖:PLA信號以紅色斑點表示。星號(*)表示遠端尖細胞。下圖:每條生殖腺中帶有PLA焦點的細胞核的百分比定量分析。顯示AMPK突變體生殖腺的單抗體對照;n=5。
G. 左圖:饑餓的WT與AMPK突變體生殖腺中增加的細胞死亡依賴于DNA損傷。通過計數生殖腺臂中異常細胞死亡(CED)-1::GFP陽性細胞來定量凋亡小體。箱線圖顯示組內平均值、50%范圍和最小到最大值,n=25。右圖:去除cep-1信號通路會增加饑餓的WT與AMPK突變體生殖腺中的胚胎致死率。定量分析之前饑餓的指定基因型動物F2后代中的胚胎致死率。樣本數量:WT,n=10;aak-1(tm1844) I,aak-2(ok524) X,n=10;aak-1(tm1844) I,aak-2(ok524)X;cep-1(gk138) I,n=20;cep-1(gk138) I,n=20。
(4)跨代遺傳的生殖缺陷:
AMPK缺失導致的異常H3K4me3和R-loop的形成不僅影響當前代,還會傳遞到未經歷饑餓的后代中,導致生殖缺陷逐漸加劇。這些表觀遺傳修飾和R-loop跨代傳遞可能通過生殖細胞中的“分子記憶”實現。

A. pie-1p::rad-51的多拷貝陣列可以部分恢復AMPK突變體在饑餓后的生殖能力。轉基因L1幼蟲在20°C下于M9緩沖液中維持72小時,隨后恢復到營養充足條件下。在恢復后96小時評估生育百分比。
B. 模型展示了在急性饑餓期間發生的AMPK依賴性事件。AMPK限制了異常的H3K4me3沉積及其隨后導致的轉錄,這種轉錄增加了R-loop的形成和基因組不穩定性。
易小結:
本研究揭示了AMPK在饑餓條件下通過調控H3K4me3沉積和R-loop形成來維持基因組穩定性和生殖細胞完整性的機制。AMPK缺失導致的異常表觀遺傳修飾和R-loop積累不僅影響當前代,還會跨代傳遞,導致生殖缺陷和基因組不穩定性。這些發現為理解環境應激與表觀遺傳修飾之間的關系提供了新的見解,并可能對人類生殖健康和癌癥研究產生重要影響。
本研究的重要意義
- 表觀遺傳修飾與基因組穩定性:研究揭示了AMPK在維持基因組穩定性中的重要作用,特別是在饑餓等應激條件下。異常的H3K4me3沉積和R-loop的形成可能導致基因組不穩定性,這在人類疾病(如癌癥)中也有類似機制。
- 跨代遺傳的表觀遺傳效應:研究表明,饑餓引起的表觀遺傳修飾可以跨代傳遞,并導致生殖缺陷。這為理解環境因素對后代健康的影響提供了新的視角。
- DNA修復與生殖細胞完整性:RAD-51的異常積累和DNA損傷響應的失調可能影響生殖細胞的正常發育和功能,從而導致生殖缺陷。
ChIP-seq和DRIP-seq在本研究中的作用
DRIP-seq(DNA-RNA免疫沉淀測序)和ChIP-seq(染色質免疫沉淀測序)是兩種關鍵的高通通量測序技術,分別用于研究R-loop的形成和組蛋白修飾的分布, DRIP-seq和ChIP-seq在本研究中共同揭示了AMPK缺失如何通過H3K4me3的異常沉積導致R-loop的形成,進而引發基因組不穩定性。
DRIP-seq專注于R-loop的全基因組分布及其與轉錄活性的關系,而ChIP-seq則專注于H3K4me3修飾的分布及其對轉錄調控的影響。
兩種技術的結合為理解AMPK在維持基因組穩定性中的作用提供了全面的視角,并揭示了表觀遺傳修飾異常如何導致跨代生殖缺陷和基因組不穩定性。
參考文獻:
Sun B, Sherrin M, Roy R. Unscheduled epigenetic modifications cause genome instability and sterility through aberrant R-loops following starvation. Nucleic Acids Res. 2023 Jan 11;51(1):84-98. pii: 6887602. doi: 10.1093/nar/gkac1155.
標簽:
DNA甲基化
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





