臍帶間充質(zhì)干細(xì)胞衍生小細(xì)胞外囊泡減輕輻射誘導(dǎo)的心臟類器官損傷研究
研究背景:
通常心臟被認(rèn)為是耐輻射器官。然而,胸部惡性腫瘤放療出現(xiàn)的心臟副作用使放射性心臟損傷受到越來越多的關(guān)注。RIHD會對心臟結(jié)構(gòu)、傳導(dǎo)系統(tǒng)和循環(huán)系統(tǒng)造成不可逆損傷。目前,盡管他汀類藥物(羥甲基戊二酰輔酶A還原酶抑制劑)、血管緊張素轉(zhuǎn)換酶抑制劑(ACEIs)和抗氧化劑在減輕輻射誘導(dǎo)的心臟損傷方面有效,但手術(shù)干預(yù)仍不可避免。因此,迫切需要開發(fā)針對 RIHD 的有效治療方法。
小細(xì)胞外囊泡(sEVs)最初被認(rèn)為是源自血小板和紅細(xì)胞的細(xì)胞殘余物,但其在組織修復(fù)、再生、信號傳導(dǎo)和誘導(dǎo)細(xì)胞分化方面的潛力已引起研究人員的日益關(guān)注。臍帶間充質(zhì)干細(xì)胞來源的sEVs(UCMSCs-sEVs)可減輕纖維化、抑制炎癥反應(yīng)、抑制氧化應(yīng)激損傷、促進(jìn)組織修復(fù)并減少細(xì)胞凋亡。這些綜合優(yōu)勢是單一藥物治療無法比擬的。UCMSCs-sEVs已在膜增生性腎小球腎炎、肝缺血-再灌注損傷和骨關(guān)節(jié)炎相關(guān)軟骨損傷等多種疾病中顯示出治療效果且無不良反應(yīng)。值得注意的是,目前關(guān)于sEVs用于治療RIHD的研究尚屬匱乏。
基于此,軍事醫(yī)學(xué)研究院王華教授團(tuán)隊(duì)與檀英霞教授團(tuán)隊(duì)近期在Stem Cell Research & Therapy雜志上發(fā)表"Small extracellular vesicles derived from umbilical cord mesenchymal stem cells alleviate radiation-induced cardiac organoid injury"相關(guān)文章。

研究方法:
本研究通過使用高分辨熒光標(biāo)測技術(shù)(Optical Mapping)對不同組類器官鈣信號活動的速度、離散度、振幅、頻率及復(fù)極時間等指標(biāo)進(jìn)行檢測,探究UCMSCs-sEVs對輻射損傷心臟類器官的治療作用。
研究結(jié)果:
1. 從人誘導(dǎo)多能干細(xì)胞(hiPSCs)構(gòu)建心臟類器官
本研究參照Hofbauer等人的實(shí)驗(yàn)方案,成功在體外構(gòu)建心臟類器官。通過96孔U型板培養(yǎng)hiPSC球體,在分化30天的免疫熒光分析表明,球體內(nèi)核含cTnT/MYL7陽性心肌細(xì)胞并表達(dá)心室標(biāo)記IRX4,外圍包膜含CDH5/PECAM1陽性心內(nèi)膜細(xì)胞及波形蛋白陽性間充質(zhì)細(xì)胞,結(jié)構(gòu)類似早期胚胎心室心內(nèi)膜。研究證實(shí),通過精準(zhǔn)信號調(diào)控構(gòu)建的心臟類器官兼具功能與結(jié)構(gòu)特征,為心臟發(fā)育及疾病研究提供有效模型。
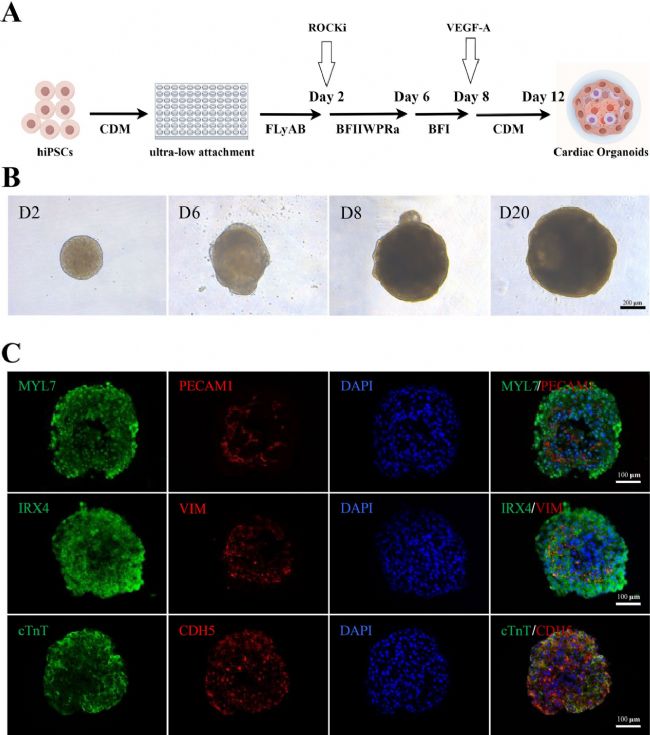
圖1 心臟類器官的制備
2. UCMSCs-sEVs的提取與鑒定
通過差速離心法從UCMSCs的上清液中提取小細(xì)胞外囊泡(sEVs)。隨后利用納米顆粒跟蹤分析(NTA)檢測UCMSCs-sEVs的粒徑分布和濃度,結(jié)果顯示其平均直徑約為138nm,濃度為5.5×10¹¹顆粒 / 毫升。透射電子顯微鏡(TEM)圖像顯示,UCMSCs-sEVs呈圓形或橢圓形,具有雙膜結(jié)構(gòu),直徑約100nm。蛋白質(zhì)印跡法(WB)結(jié)果表明,sEVs表達(dá)四次跨膜蛋白CD63、CD9及腫瘤易感基因101,同時也表達(dá)其來源細(xì)胞UCMSCs的標(biāo)記物CD90。
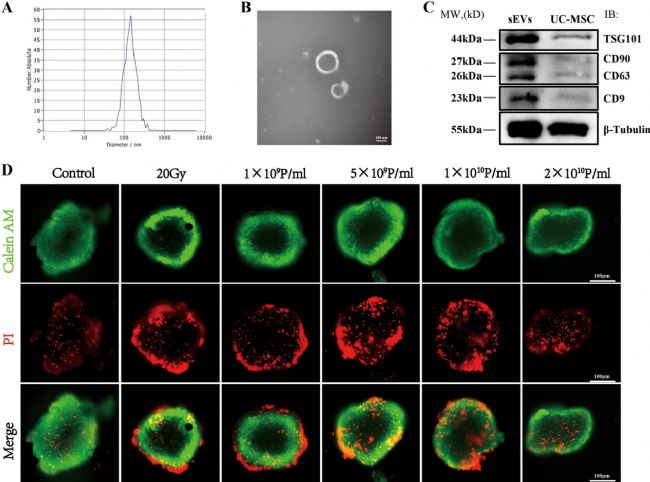
圖2 UCMSCs-sEVs的鑒定及治療濃度優(yōu)化
4. UCMSCs-sEVs治療減輕了輻射損傷的心臟類器官超微結(jié)構(gòu)損傷
線粒體為心臟供能,心肌纖維是心臟自主活動的功能基礎(chǔ),二者是心肌細(xì)胞關(guān)鍵結(jié)構(gòu)。通過TEM觀察輻射及UCMSCs-sEVs治療后心臟類器官超微結(jié)構(gòu),發(fā)現(xiàn)輻射導(dǎo)致肌纖維排列紊亂、線粒體顯著自噬及空泡化(內(nèi)膜褶皺減少),肌原纖維長度異常增加。UCMSCs-sEVs治療組中,以上現(xiàn)象被抑制。研究表明,UCMSCs-sEVs通過修復(fù)線粒體和心肌纖維超微結(jié)構(gòu)損傷,減輕輻射對心臟類器官的結(jié)構(gòu)性破壞,為其治療放射性心臟損傷提供細(xì)胞學(xué)依據(jù)。
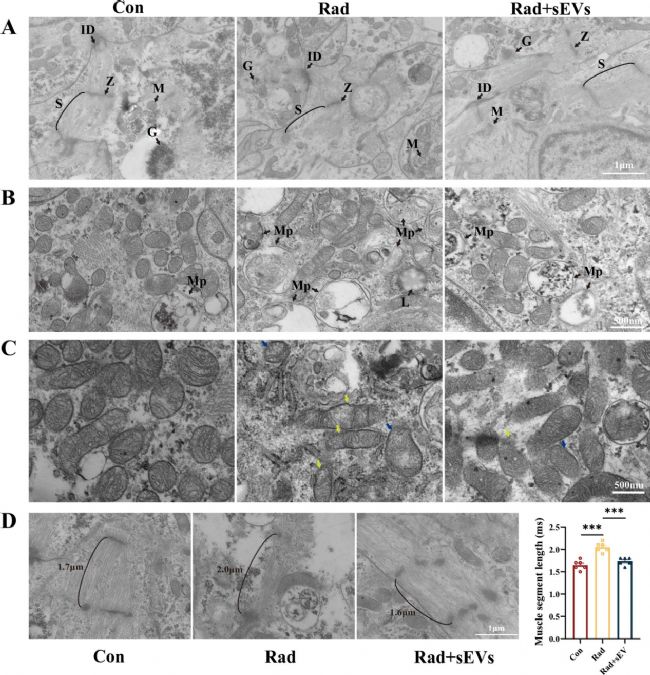
圖4 輻射和UCMSCs-sEVs治療后心臟類器官的超微結(jié)構(gòu)特征
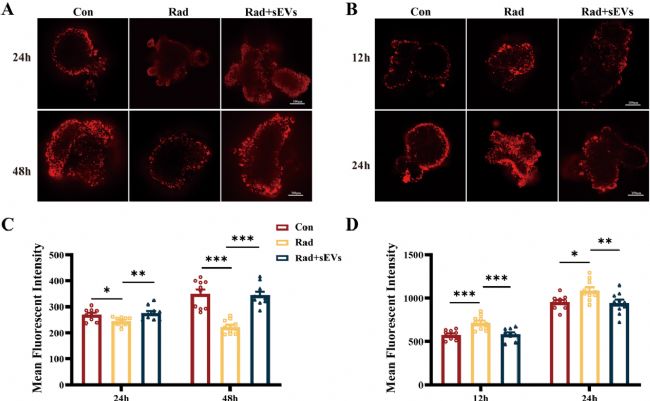
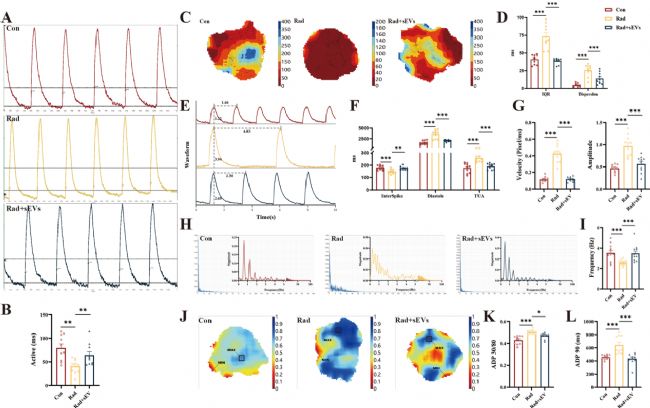
圖6 UCMSCs-sEVs恢復(fù)了輻射損傷的心臟類器官的正常鈣瞬變
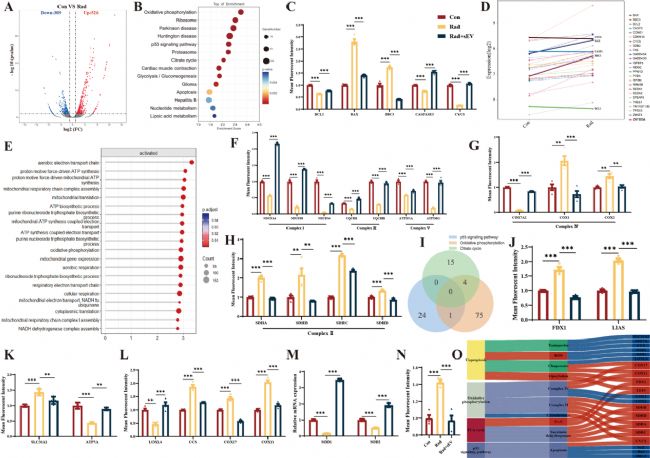
圖8 UCMSCs-sEVs在輻射誘導(dǎo)的心臟類器官損傷中的潛在作用機(jī)制
通常心臟被認(rèn)為是耐輻射器官。然而,胸部惡性腫瘤放療出現(xiàn)的心臟副作用使放射性心臟損傷受到越來越多的關(guān)注。RIHD會對心臟結(jié)構(gòu)、傳導(dǎo)系統(tǒng)和循環(huán)系統(tǒng)造成不可逆損傷。目前,盡管他汀類藥物(羥甲基戊二酰輔酶A還原酶抑制劑)、血管緊張素轉(zhuǎn)換酶抑制劑(ACEIs)和抗氧化劑在減輕輻射誘導(dǎo)的心臟損傷方面有效,但手術(shù)干預(yù)仍不可避免。因此,迫切需要開發(fā)針對 RIHD 的有效治療方法。
小細(xì)胞外囊泡(sEVs)最初被認(rèn)為是源自血小板和紅細(xì)胞的細(xì)胞殘余物,但其在組織修復(fù)、再生、信號傳導(dǎo)和誘導(dǎo)細(xì)胞分化方面的潛力已引起研究人員的日益關(guān)注。臍帶間充質(zhì)干細(xì)胞來源的sEVs(UCMSCs-sEVs)可減輕纖維化、抑制炎癥反應(yīng)、抑制氧化應(yīng)激損傷、促進(jìn)組織修復(fù)并減少細(xì)胞凋亡。這些綜合優(yōu)勢是單一藥物治療無法比擬的。UCMSCs-sEVs已在膜增生性腎小球腎炎、肝缺血-再灌注損傷和骨關(guān)節(jié)炎相關(guān)軟骨損傷等多種疾病中顯示出治療效果且無不良反應(yīng)。值得注意的是,目前關(guān)于sEVs用于治療RIHD的研究尚屬匱乏。
基于此,軍事醫(yī)學(xué)研究院王華教授團(tuán)隊(duì)與檀英霞教授團(tuán)隊(duì)近期在Stem Cell Research & Therapy雜志上發(fā)表"Small extracellular vesicles derived from umbilical cord mesenchymal stem cells alleviate radiation-induced cardiac organoid injury"相關(guān)文章。

研究方法:
本研究通過使用高分辨熒光標(biāo)測技術(shù)(Optical Mapping)對不同組類器官鈣信號活動的速度、離散度、振幅、頻率及復(fù)極時間等指標(biāo)進(jìn)行檢測,探究UCMSCs-sEVs對輻射損傷心臟類器官的治療作用。
研究結(jié)果:
1. 從人誘導(dǎo)多能干細(xì)胞(hiPSCs)構(gòu)建心臟類器官
本研究參照Hofbauer等人的實(shí)驗(yàn)方案,成功在體外構(gòu)建心臟類器官。通過96孔U型板培養(yǎng)hiPSC球體,在分化30天的免疫熒光分析表明,球體內(nèi)核含cTnT/MYL7陽性心肌細(xì)胞并表達(dá)心室標(biāo)記IRX4,外圍包膜含CDH5/PECAM1陽性心內(nèi)膜細(xì)胞及波形蛋白陽性間充質(zhì)細(xì)胞,結(jié)構(gòu)類似早期胚胎心室心內(nèi)膜。研究證實(shí),通過精準(zhǔn)信號調(diào)控構(gòu)建的心臟類器官兼具功能與結(jié)構(gòu)特征,為心臟發(fā)育及疾病研究提供有效模型。

圖1 心臟類器官的制備
2. UCMSCs-sEVs的提取與鑒定
通過差速離心法從UCMSCs的上清液中提取小細(xì)胞外囊泡(sEVs)。隨后利用納米顆粒跟蹤分析(NTA)檢測UCMSCs-sEVs的粒徑分布和濃度,結(jié)果顯示其平均直徑約為138nm,濃度為5.5×10¹¹顆粒 / 毫升。透射電子顯微鏡(TEM)圖像顯示,UCMSCs-sEVs呈圓形或橢圓形,具有雙膜結(jié)構(gòu),直徑約100nm。蛋白質(zhì)印跡法(WB)結(jié)果表明,sEVs表達(dá)四次跨膜蛋白CD63、CD9及腫瘤易感基因101,同時也表達(dá)其來源細(xì)胞UCMSCs的標(biāo)記物CD90。

圖2 UCMSCs-sEVs的鑒定及治療濃度優(yōu)化
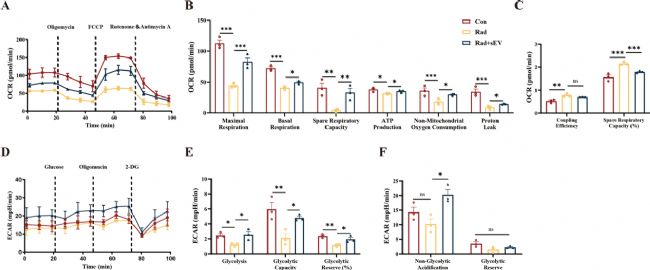
3. UCMSCs-sEVs提高了輻射損傷后心臟類器官的能量代謝能力
活/死染色顯示,20Gy X射線輻射后48小時心臟類器官損傷最顯著,優(yōu)化確定UCMSCs-sEVs治療輻射損傷的最佳濃度為2×10¹⁰顆粒 / 毫升。Seahorse分析表明,輻射導(dǎo)致心臟類器官線粒體功能下降,而UCMSCs-sEVs干預(yù)可顯著提升其最大呼吸能力、基礎(chǔ)呼吸和備用呼吸能力,增強(qiáng) ATP生成,恢復(fù)質(zhì)子漏并調(diào)節(jié)呼吸耦合效率。此外,輻射后心臟類器官糖酵解水平及儲備能力降低,UCMSCs-sEVs治療逆轉(zhuǎn)了細(xì)胞外酸化率(ECAR)異常。綜上,UCMSCs-sEVs通過改善線粒體呼吸和糖酵解功能,減輕輻射對心臟類器官的能量代謝損傷,為放射性心臟損傷治療提供實(shí)驗(yàn)依據(jù)。
活/死染色顯示,20Gy X射線輻射后48小時心臟類器官損傷最顯著,優(yōu)化確定UCMSCs-sEVs治療輻射損傷的最佳濃度為2×10¹⁰顆粒 / 毫升。Seahorse分析表明,輻射導(dǎo)致心臟類器官線粒體功能下降,而UCMSCs-sEVs干預(yù)可顯著提升其最大呼吸能力、基礎(chǔ)呼吸和備用呼吸能力,增強(qiáng) ATP生成,恢復(fù)質(zhì)子漏并調(diào)節(jié)呼吸耦合效率。此外,輻射后心臟類器官糖酵解水平及儲備能力降低,UCMSCs-sEVs治療逆轉(zhuǎn)了細(xì)胞外酸化率(ECAR)異常。綜上,UCMSCs-sEVs通過改善線粒體呼吸和糖酵解功能,減輕輻射對心臟類器官的能量代謝損傷,為放射性心臟損傷治療提供實(shí)驗(yàn)依據(jù)。

圖3 UCMSCs-sEVs提高了輻射損傷的心臟類器官的能量代謝能力
4. UCMSCs-sEVs治療減輕了輻射損傷的心臟類器官超微結(jié)構(gòu)損傷
線粒體為心臟供能,心肌纖維是心臟自主活動的功能基礎(chǔ),二者是心肌細(xì)胞關(guān)鍵結(jié)構(gòu)。通過TEM觀察輻射及UCMSCs-sEVs治療后心臟類器官超微結(jié)構(gòu),發(fā)現(xiàn)輻射導(dǎo)致肌纖維排列紊亂、線粒體顯著自噬及空泡化(內(nèi)膜褶皺減少),肌原纖維長度異常增加。UCMSCs-sEVs治療組中,以上現(xiàn)象被抑制。研究表明,UCMSCs-sEVs通過修復(fù)線粒體和心肌纖維超微結(jié)構(gòu)損傷,減輕輻射對心臟類器官的結(jié)構(gòu)性破壞,為其治療放射性心臟損傷提供細(xì)胞學(xué)依據(jù)。

圖4 輻射和UCMSCs-sEVs治療后心臟類器官的超微結(jié)構(gòu)特征
5. UCMSCs-sEVs可保護(hù)心臟類器官免受輻射引起的氧化應(yīng)激和線粒體損傷
采用TMRM染色評估輻射及不同時間點(diǎn)UCMSCs-sEVs治療后心臟類器官的線粒體膜電位(ΔΨm)。結(jié)果顯示,20Gy X射線輻射后24小時和48小時,ΔΨm(紅色熒光強(qiáng)度)下降,經(jīng)UCMSCs-sEVs治療后恢復(fù)。通過MitoSOX染色結(jié)合共聚焦顯微鏡觀察線粒體活性氧(ROS),輻射后12小時和24小時,ROS表達(dá)顯著升高,UCMSCs-sEVs治療后ROS表達(dá)被抑制。但輻射后48小時未觀察到與12小時、24小時相同的ROS升高趨勢,推測輻射對ROS的影響可能是快速且短暫的,在輻射后期效應(yīng)減弱,但輻射對ΔΨm的損傷持續(xù)存在。
采用TMRM染色評估輻射及不同時間點(diǎn)UCMSCs-sEVs治療后心臟類器官的線粒體膜電位(ΔΨm)。結(jié)果顯示,20Gy X射線輻射后24小時和48小時,ΔΨm(紅色熒光強(qiáng)度)下降,經(jīng)UCMSCs-sEVs治療后恢復(fù)。通過MitoSOX染色結(jié)合共聚焦顯微鏡觀察線粒體活性氧(ROS),輻射后12小時和24小時,ROS表達(dá)顯著升高,UCMSCs-sEVs治療后ROS表達(dá)被抑制。但輻射后48小時未觀察到與12小時、24小時相同的ROS升高趨勢,推測輻射對ROS的影響可能是快速且短暫的,在輻射后期效應(yīng)減弱,但輻射對ΔΨm的損傷持續(xù)存在。

圖5 UCMSCs-sEVs治療改善了輻射損傷的心臟類器官的線粒體膜電位,并降低了氧化應(yīng)激
6. UCMSCs-sEVs恢復(fù)了輻射損傷心臟類器官的正常鈣瞬變
鈣離子內(nèi)流是心肌興奮-收縮耦聯(lián)的特征。心臟類器官具有類似竇房結(jié)的起搏位點(diǎn),驅(qū)動整個三維球體的收縮。X射線輻射后,電子顯微鏡下觀察到肌原纖維變化,促使我們檢測心臟類器官的鈣信號。通過高分辨熒光標(biāo)測技術(shù)評估心臟類器官的鈣瞬變(calcium transients)變化,研究鈣信號活動的速度、離散度、振幅、頻率及復(fù)極時間等指標(biāo)的改變。結(jié)果表明,UCMSCs-sEVs治療逆轉(zhuǎn)了輻射損傷導(dǎo)致的鈣處理異常事件。
鈣離子內(nèi)流是心肌興奮-收縮耦聯(lián)的特征。心臟類器官具有類似竇房結(jié)的起搏位點(diǎn),驅(qū)動整個三維球體的收縮。X射線輻射后,電子顯微鏡下觀察到肌原纖維變化,促使我們檢測心臟類器官的鈣信號。通過高分辨熒光標(biāo)測技術(shù)評估心臟類器官的鈣瞬變(calcium transients)變化,研究鈣信號活動的速度、離散度、振幅、頻率及復(fù)極時間等指標(biāo)的改變。結(jié)果表明,UCMSCs-sEVs治療逆轉(zhuǎn)了輻射損傷導(dǎo)致的鈣處理異常事件。

圖6 UCMSCs-sEVs恢復(fù)了輻射損傷的心臟類器官的正常鈣瞬變
7. UCMSCs-sEVs減輕了輻射誘導(dǎo)的小鼠心臟損傷
本研究構(gòu)建了放射性心臟損傷的小鼠模型,研究發(fā)現(xiàn)輻射后第14天,小鼠多種心肌酶濃度升高(LDH1 持續(xù)升高),UCMSCs-sEVs治療顯著改善心肌酶譜。心功能檢測顯示,輻射導(dǎo)致左心室射血分?jǐn)?shù)(LVEF)和縮短分?jǐn)?shù)(LVFS)下降,治療后明顯回升。超微結(jié)構(gòu)觀察表明,該治療減輕了輻射引起的線粒體嵴減少、肌原纖維排列紊亂及膠原沉積。RT-qPCR結(jié)果顯示,輻射誘導(dǎo)促炎因子(IL-1α/β、IL-6、TNF-α)和纖維化因子(TGF-β、α-SMA、I/III 型膠原)表達(dá)升高,抗炎因子IL-10降低,而UCMSCs-sEVs治療逆轉(zhuǎn)了上述異常。心臟類器官中炎癥和纖維化相關(guān)基因的表達(dá)與在小鼠心臟中觀察到的結(jié)果一致。
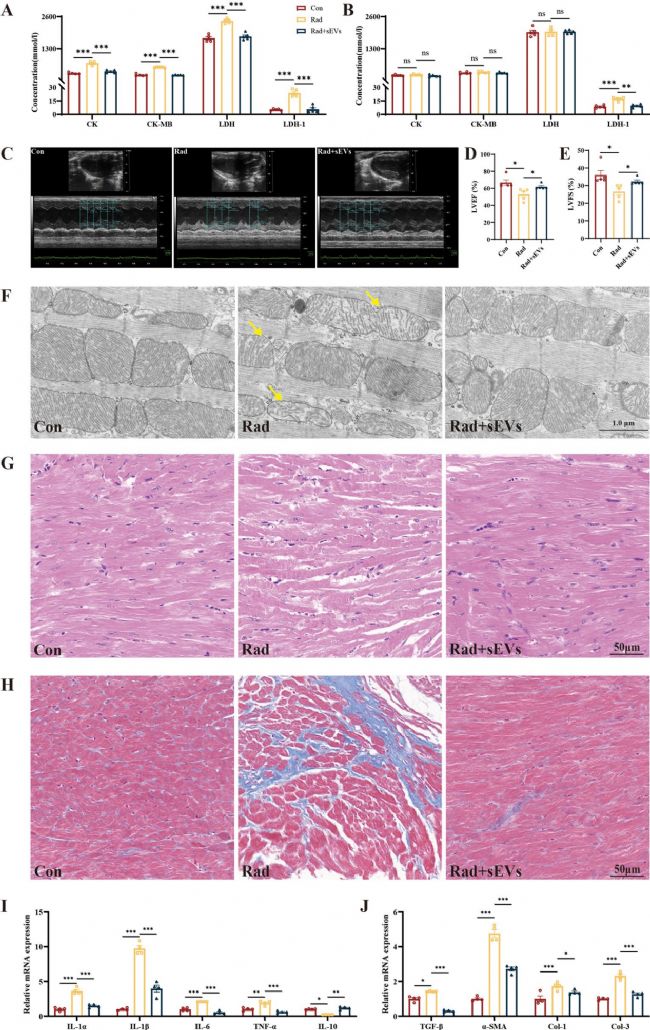
圖7 UCMSCs-sEVs對輻射誘導(dǎo)的小鼠心臟損傷的治療作用
8. 與氧化磷酸化通路和P53信號通路相互作用的銅代謝異常可能是輻射誘導(dǎo)的心臟類器官損傷的關(guān)鍵
為探究輻射損傷及UCMSCs-sEVs治療機(jī)制,對心臟類器官進(jìn)行RNA-seq分析,發(fā)現(xiàn)835個差異表達(dá)基因(DEGs),富集到p53信號通路。UCMSCs-sEVs通過調(diào)控p53信號、修復(fù)氧化磷酸化及相關(guān)通路,逆轉(zhuǎn)輻射誘導(dǎo)的基因表達(dá)異常,為放射性心臟損傷治療提供分子機(jī)制證據(jù)。
為探究輻射損傷及UCMSCs-sEVs治療機(jī)制,對心臟類器官進(jìn)行RNA-seq分析,發(fā)現(xiàn)835個差異表達(dá)基因(DEGs),富集到p53信號通路。UCMSCs-sEVs通過調(diào)控p53信號、修復(fù)氧化磷酸化及相關(guān)通路,逆轉(zhuǎn)輻射誘導(dǎo)的基因表達(dá)異常,為放射性心臟損傷治療提供分子機(jī)制證據(jù)。

圖8 UCMSCs-sEVs在輻射誘導(dǎo)的心臟類器官損傷中的潛在作用機(jī)制
結(jié)論:
本研究利用UCMSCs-sEVs治療放射性心臟類器官損傷(RICoI),對線粒體結(jié)構(gòu)和功能以及電信號傳導(dǎo)的觀察,發(fā)現(xiàn)其對RICoI具有顯著治療效果。這種治療作用可能歸因于p53信號通路、氧化磷酸化信號通路及銅離子積累的協(xié)同效應(yīng)。該研究首次報道輻射可誘導(dǎo)心臟類器官發(fā)生銅死亡(cuproptosis),并證實(shí)UCMSCs-sEVs能夠緩解RICoI及放射性缺血性心臟病(RIHD)。這些發(fā)現(xiàn)不僅有助于理解放射性心臟損傷,也為RIHD的治療提供了新策略。
本研究利用UCMSCs-sEVs治療放射性心臟類器官損傷(RICoI),對線粒體結(jié)構(gòu)和功能以及電信號傳導(dǎo)的觀察,發(fā)現(xiàn)其對RICoI具有顯著治療效果。這種治療作用可能歸因于p53信號通路、氧化磷酸化信號通路及銅離子積累的協(xié)同效應(yīng)。該研究首次報道輻射可誘導(dǎo)心臟類器官發(fā)生銅死亡(cuproptosis),并證實(shí)UCMSCs-sEVs能夠緩解RICoI及放射性缺血性心臟病(RIHD)。這些發(fā)現(xiàn)不僅有助于理解放射性心臟損傷,也為RIHD的治療提供了新策略。
- 臍帶間充質(zhì)干細(xì)胞衍生小細(xì)胞外囊泡減輕輻射誘導(dǎo)的心臟類器官損傷研究
- Pak2在心臟應(yīng)激和肥厚相關(guān)室性心律失常中的保護(hù)作用研究
- 對完整RyR2-R2474S突變小鼠心臟的電壓和鈣信號的光學(xué)標(biāo)測研究
- Dario Farina 綜述:過去20年間高密度表面肌電神經(jīng)提取應(yīng)用進(jìn)展
- 利用雙因子技術(shù)穩(wěn)定血管再生并改善心梗后心功的研究
- 跨膜電阻儀CellzScope助力血腦屏障研究新突破
- 創(chuàng)新組織透明技術(shù)在無標(biāo)記腦成像的應(yīng)用
- 心肌補(bǔ)片通過調(diào)節(jié)CCR2-巨噬細(xì)胞生態(tài)位促進(jìn)心臟修復(fù)的研究
Copyright(C) 1998-2025 生物器材網(wǎng) 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





