PD-L1 IHC抗體藥物的作用機理、種類及病理診斷要點
PD-1/PD-L1藥物的作用機理是阻斷腫瘤細胞PD-L1和T細胞表面PD-1之間的識別。簡單來說腫瘤細胞表面表達PD-L1,當PD-L1與T細胞PD-1相互識別后提供了T細胞的抑制信號,誘導T細胞凋亡、抑制T細胞的活化增殖。當使用PD-1/PD-L1藥物后,兩者的識別被阻斷,T細胞恢復對腫瘤的免疫能力,從而達到腫瘤治療的目的。
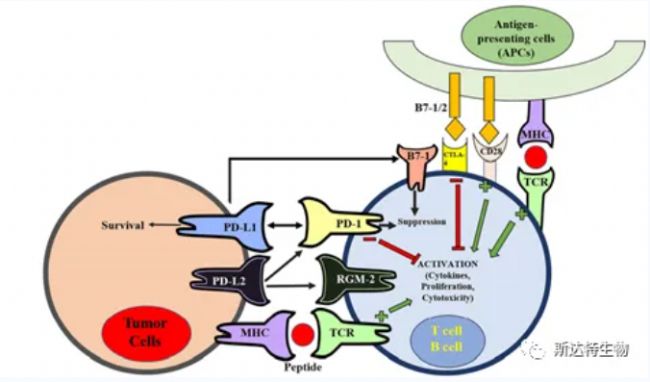 圖1:PD-1/PD-L1示意圖
圖1:PD-1/PD-L1示意圖
目前上市的PD-1/PD-L1的藥物多用于治療肺癌、霍奇金淋巴瘤、食管癌等癌癥。繼2018年6月國內首個PD-1藥物上市以來,國內PD-1/PD-L1上市藥物已經達到15種(包括阿斯利康的CTLA-4與PD-L1聯合用藥)。2022年默沙東的K藥(可瑞達)銷售額已經達到209.37億美元,穩坐全球同類藥物銷售額排名第二寶座。

免疫組織化學檢測PD-L1作為PD-1/PD-L1治療的預測性生物標志物。
根據《實體腫瘤PD-L1免疫組織檢測專家共識(2021版)》的介紹,有以下問題及共識要點:
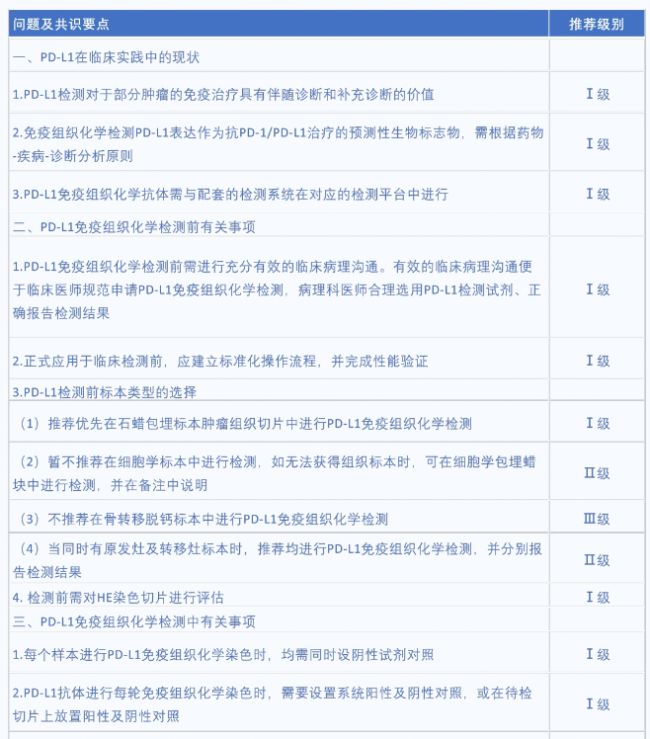
 注:Ⅰ級:證據級別高,依據大規模臨床藥物實驗獲得的結論;Ⅱ級:證據級別較高、專家共識度稍低,無直接相關的臨床藥物實驗依據;Ⅲ級:臨床實用但證據級別不高,循證醫學證據不足,但是專家組認為可行。
注:Ⅰ級:證據級別高,依據大規模臨床藥物實驗獲得的結論;Ⅱ級:證據級別較高、專家共識度稍低,無直接相關的臨床藥物實驗依據;Ⅲ級:臨床實用但證據級別不高,循證醫學證據不足,但是專家組認為可行。
病理檢測的核心是高質量的抗體,高特異性、高靈敏度的PD-L1抗體是伴隨診斷的重中之重。
《實體腫瘤PD-L1免疫組織檢測專家共識(2021版)》對于目前使用的抗體的閾值也做出了整理說明。
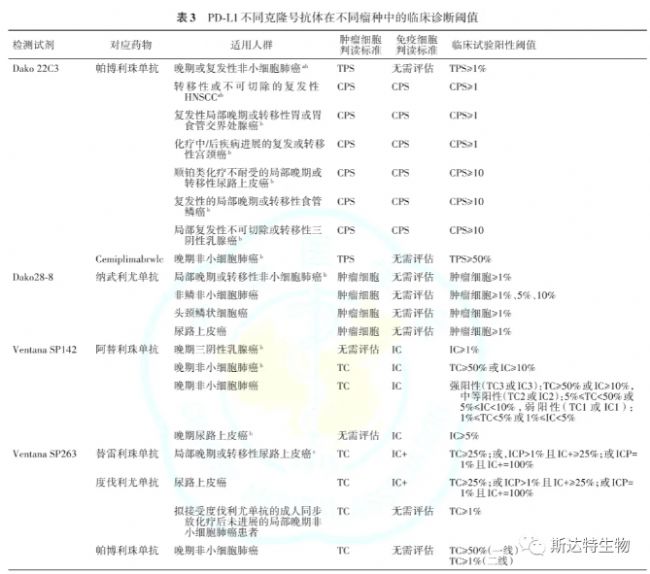 注:a.國家藥品監督管理局(NMPA)已批準Dako PD-L1 22C3免疫組織化學檢測試劑盒作為帕博利珠單抗藥物一線治療表皮生長因子受體陰性及間變性淋巴瘤激酶陰性的局部晚期或轉移性非小細胞肺癌及食管鱗狀細胞癌的伴隨診斷;b.美國食品藥品監督管理局(FDA)已批準PD-L1免疫組織化學檢測在該腫瘤的對應適應癥中作為免疫治療藥物的伴隨診斷;c.NMPA已批準Ventana SP263免疫組織化學檢測試劑盒作為替雷利珠單抗治療含鉑化療失敗的局部晚期或轉移性尿路上皮癌的伴隨診斷;TPS:腫瘤比例評分;CPS:聯合陽性評分;TC:腫瘤細胞;IC:免疫細胞
注:a.國家藥品監督管理局(NMPA)已批準Dako PD-L1 22C3免疫組織化學檢測試劑盒作為帕博利珠單抗藥物一線治療表皮生長因子受體陰性及間變性淋巴瘤激酶陰性的局部晚期或轉移性非小細胞肺癌及食管鱗狀細胞癌的伴隨診斷;b.美國食品藥品監督管理局(FDA)已批準PD-L1免疫組織化學檢測在該腫瘤的對應適應癥中作為免疫治療藥物的伴隨診斷;c.NMPA已批準Ventana SP263免疫組織化學檢測試劑盒作為替雷利珠單抗治療含鉑化療失敗的局部晚期或轉移性尿路上皮癌的伴隨診斷;TPS:腫瘤比例評分;CPS:聯合陽性評分;TC:腫瘤細胞;IC:免疫細胞
依據各腫瘤的臨床試驗與患者的療效相關數據,在不同的腫瘤中建立了不盡相同的評分體系及臨床閾值,以反映PD-L1表達的水平與免疫治療藥物療效的相關性。
目前對于PD-L1陽性結果的判定分為以下檢測方法:
1.腫瘤陽性比例評分
2.腫瘤免疫細胞陽性評分
3.聯合陽性評分
高靈敏度-特異性PD-L1病理抗體
斯達特高特異性的PD-L1抗體對于人小細胞性肺癌組織具有高特異性和靈敏度,能夠準確識別腫瘤細胞上表達PD-L1蛋白,界限清晰,與細胞質等陰性位置區別明顯。抗體可用于PD-L1體外伴隨診斷試劑盒開發、商用抗體開發等。
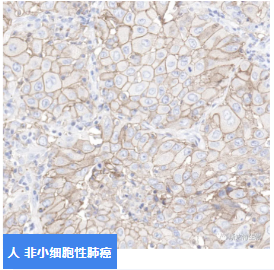
貨號:S0B2067
IHC shows positive staining in paraffin-embedded human lung cancer.
Anti-PD-L1 antibody was used at 1/100 dilution, followed by a Goat Anti-Rabbit IgG H&L (HRP) ready to use.
Counterstained with hematoxylin.Heat mediated antigen retrieval with Tris/EDTA buffer pH9.0 was performed before commencing with IHC staining protocol.
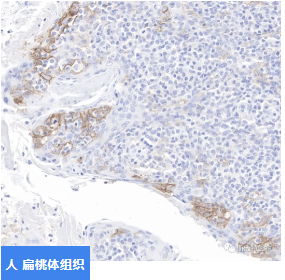
貨號:S0B2068
IHC shows positive staining in paraffin-embedded human tonsil.
Anti-PD-L1 antibody was used at 1/100 dilution, followed by a Goat Anti-Rabbit
相關產品:






