腫瘤靶點的“新寵”Claudin18.2抗體的作用機制及對腫瘤治療的影響
胃癌是全球腫瘤相關死亡排名第三的癌癥。胃癌有強大的轉移能力,常見的轉移位置為腹膜、淋巴結、肝、肺和骨骼。在轉移的過程中,上皮-間質轉移是腫瘤細胞產生轉移表型的重要一步。上皮間質轉移的第一步是表皮細胞之間聯系斷開,比如緊密連接(TJs)、粘附連接、橋粒和間隙連接。TJs包含內源性膜蛋白,例如CLDN和occludin和細胞質蛋白Zonula occludens 1(ZO1),ZO2,ZO3,這些都是跨膜蛋白。他們起到鏈接細胞骨架蛋白和信號轉導的作用。總的來說CLDNs在細胞框架和細胞-細胞粘附和轉移中起到重要作用。
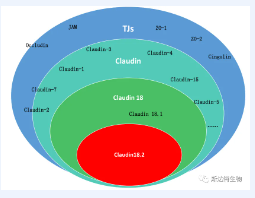
參考文獻1:細胞間緊密連接蛋白
CLDN18.2限制性表達于分化成熟的胃粘膜上皮細胞以及多種腫瘤細胞表面,在胃正常組織中維持胃粘膜的屏障功能,通過細胞旁途徑防止胃酸中的H+泄露。
在胃上皮組織惡性轉化時,細胞極性的擾動導致CLDN18.2表位的細胞表面暴露以及在特定腫瘤組織中高度、選擇性和穩定表達。CLDN18.2在人、黑猩猩、獼猴、小鼠、大鼠、狗、兔等動物物種間的同源性高達84%,這為藥物開發前期的安全性和有效性試驗提供了極大便利。
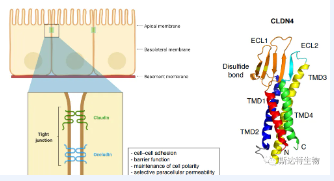
參考文獻2:細胞膜Claudin示意圖
01 CLDN18.2 分子特征
CLDN18.2基因位于人染色體3q22位點,由261個氨基酸組成,為四次跨膜結構。相對分子質量27700,其氨基和羧基端均位于細胞膜內側。CLDN18.2有2個胞外環結構域,胞外環是由53個氨基酸構成的4個反向折疊的β片層組成,其中β3和β4之間存在2個高度保守的半胱氨酸,他們之間形成的二硫鍵有利于分子結構的穩定。胞外環2由31個氨基酸組成。
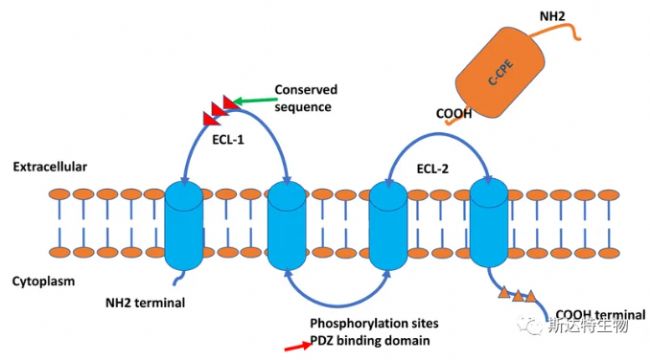
02 CLDN18.2 調控與表達
有研究表明 PMA(十四烷酰佛波醇乙酸酯)通過激活PKC(蛋白激酶C)來上調CLDN18.2的表達。使用PKC的抑制劑GF109203X預處理胃癌細胞系,PMA不能使CLDN18.2表達上調,說明PKC與CLDN18.2的表達有關。
CLDN18.2啟動子區域轉錄激活因子AP1結合位點參與了PMA上調CLDN18.2的過程。
CLDN18.2啟動子區域的存在CpG島,正常肺組織、外周血單核細胞等不表達CLDN18.2的組織或細胞中,CLDN18.2啟動子區域的CpG完全甲基化,在正常的胃組織細胞,肺癌細胞等腫瘤細胞系中CpG島的甲基化程度較低。
03 CLDN18.2 相關腫瘤疾及藥物研究者最初在胃癌組織中發現CLDN18.2一致和穩定的表達,后續在乳腺癌、直腸癌、肝癌、頭部和頸部癌癥、支氣管癌癥、非小細胞性肺癌尤其是消化系統的食管癌中均有表達。
有研究將來自于胃印戒細胞癌的105個樣本進行免疫組化染色發現95.2%的樣本呈現陽性。中等至強度的CLDN18.2的表達大約占64.8%。其中有21%的樣本90%以上的癌細胞呈現陽性。
隨著CLDN18.2陽性的腫瘤數量增加,研究人員發現這些腫瘤可能同時是甲狀腺轉錄因子陰性腺瘤,這說明CLDN18.2有可能是判斷甲狀腺轉錄因子陰性的指標。
CLDN18.2不僅在原始腫瘤表達,也在轉移性腫瘤高表達并且與惡性腫瘤的增殖和趨化有關。在一項胰腺癌轉移患者的研究中,人們發現在淋巴結轉移組織、肝癌轉移組織、肺轉移性組織中CLDN18.2的陽性率分別為70%、66%、59%。
轉移性淋巴結中的CLDN18.2表達明顯高于原發淋巴結腫瘤,且與淋巴結CLDN18.2陽性患者的預后有關。CLDN18.2陽性與淋巴結轉移具體機制尚不清楚,但是可能與CLDN18.2改變惡性腫瘤細胞間緊密連接的結構和功能有關。
CLDN18.2陽性的腫瘤治療與進展:
靶向CLDN18.2的陽性腫瘤的治療方案包括單抗、雙特異性抗體、CAR-T、ADC藥物等。截止2022年1月底,國內有15項臨床試驗正在進行中,國外有28個。這些臨床試驗主要靶向實體瘤包括晚期不可切除胃癌、轉移性食管癌、胰腺癌等。共有22個用單抗,3個用雙特異性抗體,9個用的CAR-T治療,9個用的ADC藥物治療。
單抗:
1、Claudiximab是由德國Ganymed開發的人IgG1恒定區鼠嵌合單抗,可特異性、高親和力地識別CLDN18.2蛋白細胞膜外第一個細胞外域(ECD1)且不與其他家族成員結合。多項臨床試驗表明,Claudiximab能夠誘導體外培養的陽性胰腺細胞凋亡,且殺傷能力與細胞表面蛋白表達水平呈現正相關。聯合使用化療藥物吉西他濱可上調人胰腺癌細胞蛋白表達并增強CLDN18.2介導的ADCC作用。
2、TST1001是新的人源化的IgG1抗體 與Claudiximab相比,TST1001缺少巖藻糖基化,與FcγRⅢa結合親和力更高,因此能夠誘導更強烈的ADCC作用。同時,TST1001比Claudiximab有更強的CDC和ADCP的作用。臨床Ⅰ期劑量遞增試驗中,在經化療、PD-1免疫治療、VEGF抑制劑等治療的晚期胃癌患者中,TST1001治療6周癥狀部分緩解。其中一位病人的腫瘤標志物有快速和明顯的降低。在TST1001聯合治療試驗中,同樣在6周緩解部分癥狀。
雙抗:
1、AMG-910 是半衰期延長的HLE BiTE(Bispecifc T-cell Engager) 能夠靶向CD3陽性的T細胞和CLDN18.2陽性的腫瘤細胞。關于AMG-910第一個臨床終點包括劑量限制毒性、治療的副作用,第二個臨床終點包括AMG-910的藥代動力學、客觀反應、反應持續時間、進展時間、6個月和1年無進展生存期以及1年和2年的總生存率。
2、Q-1802 是靶向PD-L1和CLDN18.2的雙特異性抗體,可介導ADCC作用。另一方面,PD-L1抗體阻斷了PD-1/PD-L1 的相互識別啟動免疫反應。目前該藥物的臨床Ⅰ期試驗正在進行中。
除了以上單抗和雙抗,采用CAR-T的CT041、LY011、LCAR-C18S,以ADC為基礎的CMG901、SYSA-1801、RC118等藥物的臨床試驗均在進行中。
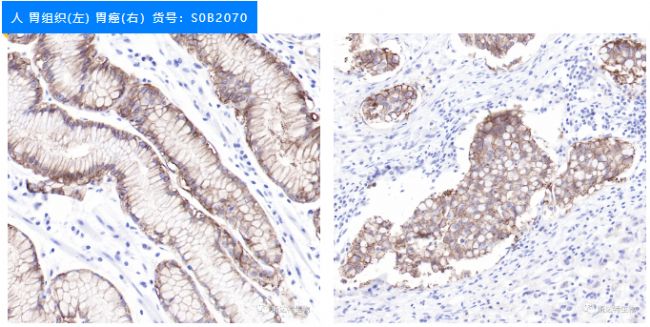
高親和力IHC應用CLDN18.2抗體
人 胃組織(左) 胃癌(右)貨號:S0B2070