腫瘤壞死因子超家族(TNFSF)的組成與結構及在病理過程中的作用
腫瘤壞死因子超家族(Tumor Necrosis Factor Superfamily, TNFSF)是一類在生物學上具有廣泛而重要作用的蛋白質家族。這類蛋白質主要由免疫細胞表達,并通過與其相應的受體結合,調節多種細胞功能,包括免疫反應、炎癥反應、細胞增殖、分化、凋亡以及胚胎發生等。TNFSF在維持機體穩態和應對外界刺激中發揮著關鍵作用。
01 TNFSF的組成與結構
TNFSF是一類II型跨膜蛋白超家族,其成員在C末端均含有TNF同源結構域(TNF Homology Domain, THD)。這一結構域是TNFSF成員與受體結合的關鍵部位,它促使配體和受體形成三聚體復合物,從而有效激活細胞內信號通路。TNFSF成員的胞外區C端含有約150個氨基酸的同源序列,這些序列通過特定的折疊方式形成春卷樣的空間結構,為與受體結合提供了基礎。
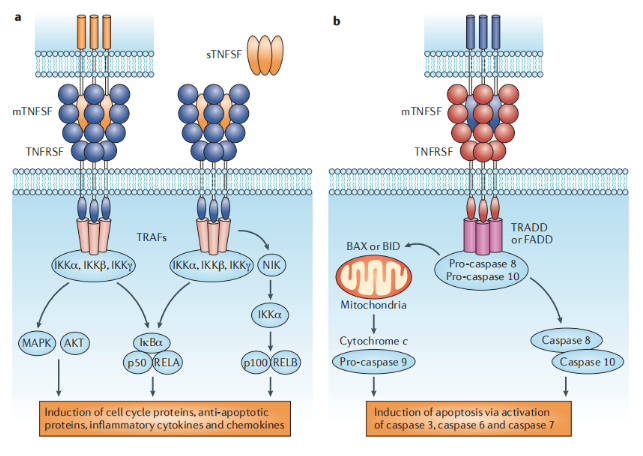
TNFSF成員的促炎和誘導死亡活性。來源:NATURE REVIEWS | DRUG DISCOVERY
腫瘤壞死因子超家族(TNFSF)分子具有典型的TNF同源結構域,主要作為非共價結合的同源三聚體起作用。TNF受體超家族(TNFRSF)分子在其配體結合胞外區域(胞外結構域)中含有不同數量的富含半胱氨酸的結構域。可溶性或膜表達的TNFSF分子(分別為sTNFSF和mTNFSF)可以通過將TNFRSF單體(例如TNFR2、CD40、OX40、B細胞活化因子受體(BAFFR)和NF-κB受體激活劑配體(RANK))組織成三聚體或寡聚體結構來促進存活或炎癥信號傳導,從而允許募集稱為TNFR相關因子(TRAF)的銜接分子,從而激活絲氨酸/蘇氨酸激酶依賴性途徑。
TNFSF分子可以通過將含有死亡結構域的TNFRSF單體(例如TNFR1、FAS和TNF相關的凋亡誘導配體受體(TRAILR))組織成三聚體或寡聚體結構,從而募集含有死亡效應結構域(例如TNFR相關死亡結構域蛋白(TRADD)和FAS相關死亡結構域蛋白(FADD))的銜接分子,從而激活半胱氨酸/天冬氨酸蛋白酶(caspases),從而促進凋亡細胞死亡。BAX,BCL-2相關X蛋白;BID,BH3相互作用結構域死亡激動劑;IκBα,κB抑制劑;IKKα,IκB激酶α;MAPK,絲裂原活化蛋白激酶;NIK,NF-κB誘導激酶;p50,NF-κB亞基p50;p100,NF-κB前體蛋白p100;RELA,轉錄因子p65。
目前,已經鑒定出19種TNFSF配體,它們分別是TNF-α、TNF-β(也稱為LT-α)、CD40L、FasL、TRAIL、RANKL等。這些配體在結構上具有高度的相似性,但在功能上卻各有側重,通過與不同的受體結合,參與調節多種生物學過程。
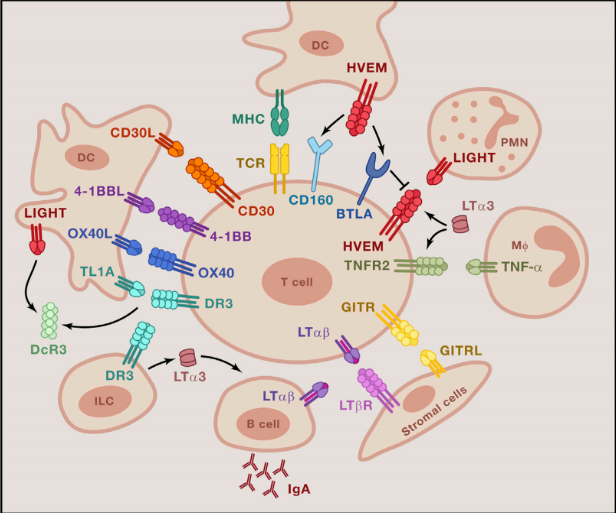
共刺激TNFRSF形成的細胞間網絡。來源:Immunity
許多共刺激TNFRSF成員在激活的T淋巴細胞中表達,其特異性配體在專業抗原呈遞細胞(APC)、中性粒細胞、巨噬細胞或間質細胞中表達。膜錨定的表達模式限制了信號傳遞至細胞間接觸,而一些配體或受體以可溶形式釋放,可在全身發揮作用。
02 TNFSF與疾病的關系
TNFSF家族包含更多的成員,每個成員可能涉及多種功能和疾病。此外,由于不同成員可能具有相似或重疊的功能,它們在疾病中的作用可能相互關聯。
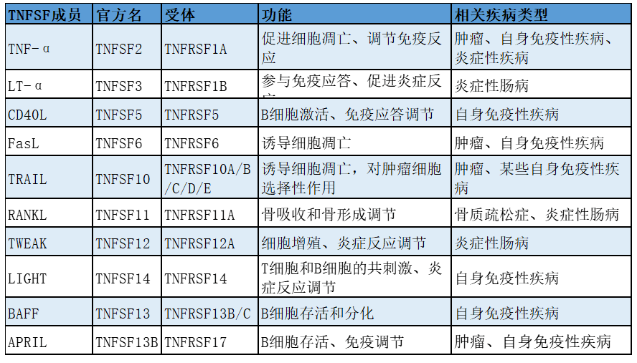
上述信息僅提供了一些示例,用于說明TNFSF成員的多樣性和它們在病理過程中的潛在作用。
TNFSF家族成員在腫瘤、自身免疫性疾病及炎癥性疾病中扮演關鍵角色。TNF-α在多種腫瘤中異常表達,促進腫瘤生長、血管生成及侵襲轉移,同時抑制細胞凋亡。TRAIL則因其能選擇性誘導腫瘤細胞凋亡而備受關注,成為腫瘤治療新靶點。此外,CD40L過度表達與多種自身免疫病相關,如紅斑狼瘡和類風濕性關節炎,可激活過強免疫反應,損傷組織。RANKL/RANK信號異常也關聯骨質疏松。
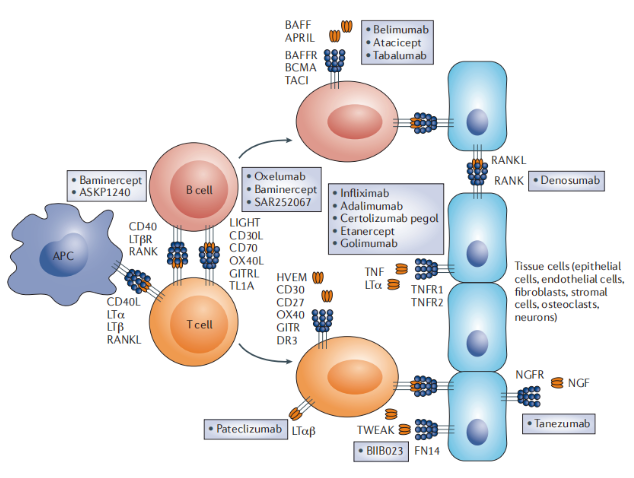
TNFSF靶點及其在自身免疫和炎癥中的治療作用。來源:NATURE REVIEWS | DRUG DISCOVERY
上圖突出顯示了免疫系統中(抗原呈遞細胞(APC)、B細胞和T細胞)以及組織細胞(如上皮細胞、內皮細胞、成纖維細胞、基質細胞、破骨細胞和神經元)之間的一些可能的相互作用。這些細胞可以通過腫瘤壞死因子超家族(TNFSF)和腫瘤壞死因子受體超家族(TNFRSF)分子之間的相互作用進行控制,從而產生典型的自身免疫和炎癥性疾病的刺激或促炎活性。
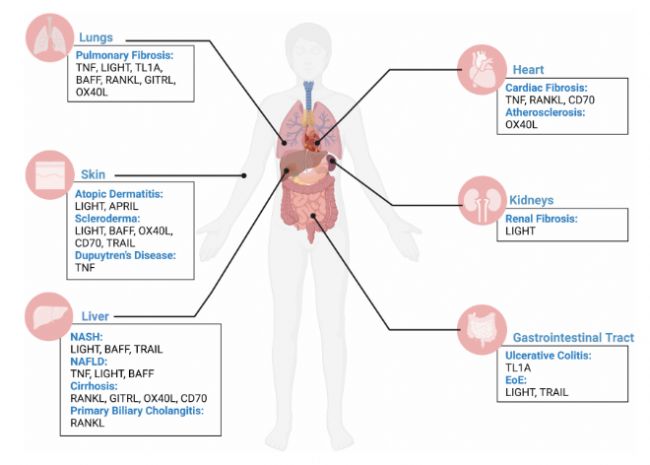
TNFSF家族與人體的一些疾病。來源:Frontiers in immunology
展望
隨著對TNFSF研究的深入,越來越多的TNFSF成員成為藥物開發的重要靶點。針對TNFSF成員的藥物已經在多種疾病的治療中展現出良好的療效和安全性。例如,針對RANKL的Denosumab生物類似藥已獲得國家藥品監督管理局臨床試驗注冊審評受理,用于治療骨質疏松癥。Denosumab能夠特異性地結合RANKL,抑制破骨細胞的生成和活性,從而增加骨密度并降低骨折風險。此外,針對TNF-α、CD40L等TNFSF成員的抑制劑也在臨床試驗中展現出良好的療效和安全性。例如,針對TNF-α的抑制劑已經廣泛應用于類風濕性關節炎、炎癥性腸病等多種炎癥性疾病的治療中。
TNFSF是細胞因子家族中一個多樣化且功能豐富的群體。它們在維持機體穩態和免疫反應中發揮著關鍵作用。深入理解TNFSF成員的生物學特性和作用機制,對于開發新的治療策略和改善相關疾病的治療效果具有重要意義。
產品信息
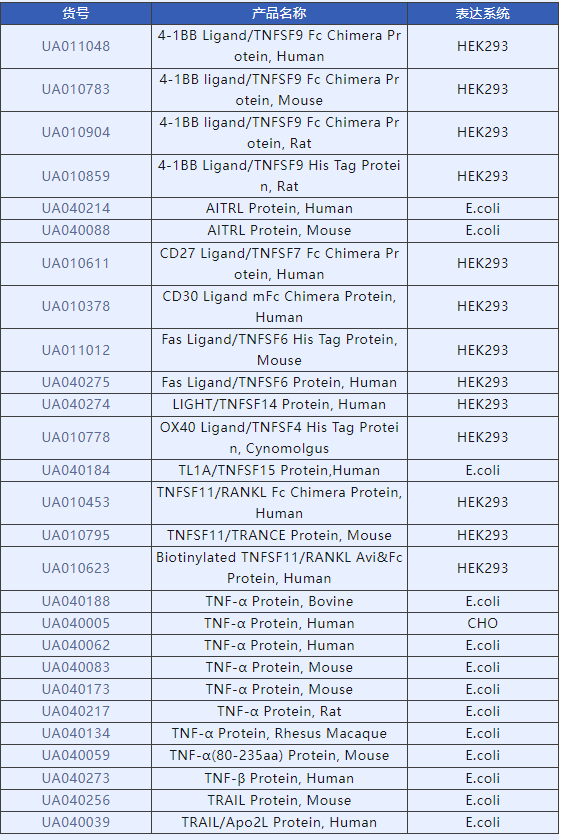
杭州斯達特(www.starter-bio.com)志在為全球生命科學行業提供優質的抗體、蛋白、試劑盒等產品及研發服務。依托多個開發平臺:重組兔單抗、重組鼠單抗、快速鼠單抗,重組蛋白開發平臺(E.coli,CHO,HEK293,Insect Cells),已正式通過歐盟98/79/EC認證、ISO9001認證ISO13485。





