開啟2020年科研新熱點的染色體外環狀DNA(eccDNA)
文章導讀
近期,Nature與Cell相繼發表文章討論染色體外環狀DNA(eccDNA),這位超級明星在各家媒體、宣傳號上紛紛閃亮登場。一時間eccDNA走在了生物醫學研究舞臺的最中央,云序生物已經帶您領略過eccDNA在這兩篇重量級文章中的迷人風采(點擊鏈接:顛覆性發現:癌基因竟不在染色體上---環狀DNA連登Nature,Cell!),它極大的豐富了腫瘤異質性的研究內容,為液體活檢、腫瘤耐藥以及腫瘤微環境討論指明了新的方向。eccDNA在腫瘤環境中可以借助多樣的成環方式、開放的高級結構以及多個調控元件的輔助,強有力的推動原癌基因的轉錄,顛覆了科研人員對原癌基因在腫瘤發生發展當中的傳統認知。染色質是動態的!eccDNA也是動態的!
雖然eccDNA的討論內容多數圍繞腫瘤環境,那eccDNA是否是腫瘤學的專屬明星分子?并非如此,非疾病狀態下的細胞核同樣擁有豐富的eccDNA。云序生物今天帶來的文章將讓大家感受到,eccDNA在正常的人體細胞中(組織、血液)依舊存在,DNA的成環現象非常普遍。

原文鏈接:Circular DNA elements of chromosomal origin are common in healthy human somatic tissue
發表期刊:Nature Communication
影響因子:11.878
發表日期: 2018.08
實驗方法:eccDNA-seq RNA-seq(云序生物提供以上服務)
文章內容
1. eccDNA成環的整體統
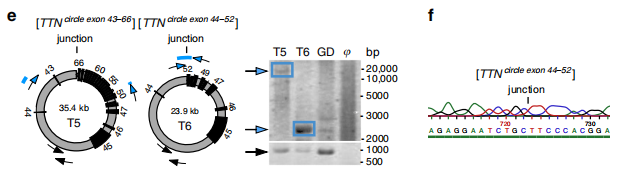
圖1 來源于TNN基因的兩例eccDNA
2.eccDNA長度分布與來源探索
eccDNA是環狀結構,這樣一種分子的長度分布如何?測序結果顯示99%的eccDNA長度小于25Kb,其中僅有占比約1%的分子大于25Kb。在這99% 當中,在0.1Kb以及5Kb處有富集峰,這表明該區段的eccDNA占絕大多數。經典的知識體系告訴我們重復序列以及5sRNA部分最容易成環,事實上測序結果也充分證明這一點,SINE(3.1%)、LINE(3.5%),中心粒(2.0%),以及sRNA(8.1%)部分是最經典的成環結構,大量的環能夠匹配到這些區域。
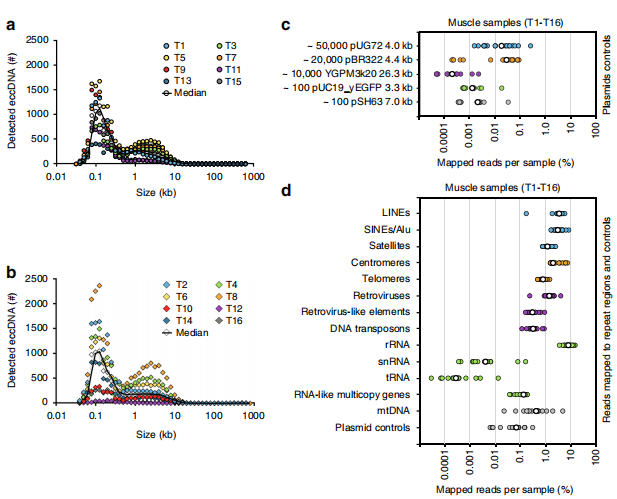
圖2 eccDNA長度分布和來源多樣性
3.eccDNA基因組分布
前文提到99% eccDNA小于25Kb,作者分別探索這些eccDNA來源于哪些染色體。結果顯示所有染色體對eccDNA都有所貢獻。其中小于25Kb部分的環狀在染色體上的分布相對密集。

圖3 eccDNA的染色體分布
4. eccDNA形成的基因偏好性
既然每一條染色體都有可能成環,都對eccDNA多樣性產生巨大貢獻,那eccDNA產生是否有一定的偏好性呢?文章測序結果顯示17和19號染色體成環的可能性最大,由于17號染色體有相對多的編碼基因,研究者猜測成環的可能性可能與編碼基因數目呈正相關。
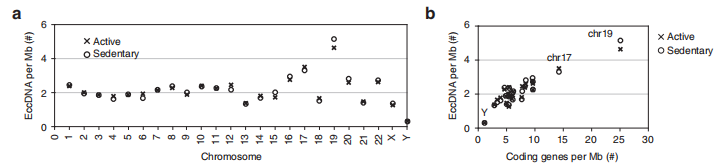
圖4 17號與19號染色體對eccDNA貢獻最大
5. eccDNA具有轉錄活性
eccDNA能夠高效擴增成環序列,這種擴增是否有轉錄活性?RNA轉錄本是否僅僅來源于傳統線性的染色體?要回答這一問題,作者通過RNA-seq(云序提供該服務)進行探索,結果發現split-reads,即在RNA-seq測序的結果當中同樣發現了能夠跨過相同剪切位點的測序片段,這種片段的剪切位點和eccDNA成環的剪切位點序列保持一致,說明環形的eccDNA也具有轉錄活性,這一點非常重要,這很有可能造成成環基因(尤其原癌基因和耐藥基因)在轉錄本水平的明顯高表達從而進一步促進癌癥的發生發展,是非常具有臨床意義的研究成果。
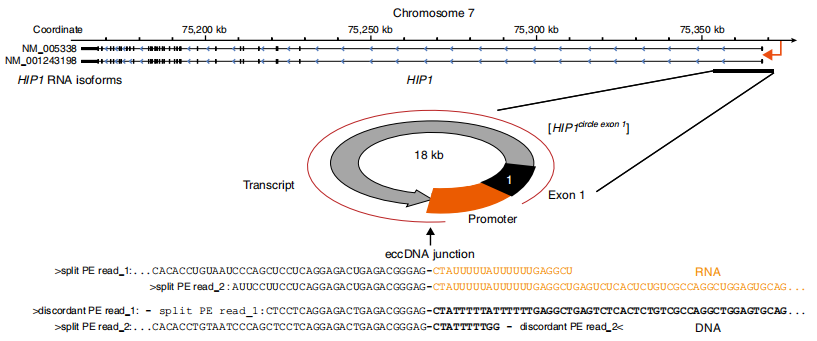
圖5 HIP1形成eccDNA具有轉錄活性
6. eccDNA成環驗證
類比于經典的circRNA,eccDNA的形成具有相似性,也是經過核酸序列的反式鏈接得到的產物。當然有關于成環機制的問題依然還需要大量的研究討論。不過對于環狀的結構驗證可以模仿circRNA,針對junction site,就是鏈接位點設計發散引物(divergent primer)同時設計收斂引物(convergent primer)進行PCR擴增,然后通過Sanger測序的方式驗證eccDNA的接頭序列。
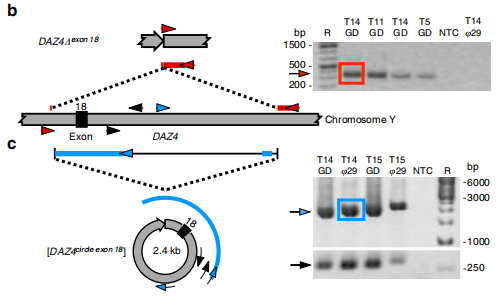
圖6 eccDNA的驗證
總結
從eccDNA全新視角理解生物過程的發生發展,這篇Nature Communication文章提供了最好的參照。研究者在進行eccDNA-seq之后對高通量數據進行整理歸納,從eccDNA的個數、長度、來源、分布和基因相關性進行深入分析,造就一篇10分以上“表達譜”的文章。這將會是一個契機,通過快速的eccDNA-seq結合PCR方式率先用“譜”的方式快速闡述一個疾病當中哪些基因易于成環、哪些基因擴增效率更高并快速和疾病的發生發展建立聯系,有理由相信這種雖然簡單但是高度創新的文章一定會備受矚目,影響因子再創新高。
eccDNA以顛覆傳統認知的方式重新走到科研舞臺的中心,必將在未來的一段時間掀起一場有關基因擴增、轉錄的大討論。我們已經習慣了觀察基因的缺失、突變、插入和移位,eccDNA的產生從新的角度讓科研工作者去思考基因組存在的動態性和多樣性。由此,腫瘤的異質性、腫瘤微環境、液體活檢和耐藥性等相關研究必定會圍繞eccDNA展開更多集中式的研究和探索,有理由相信這次2019年年末的Nature和Cell文章的發表將成為里程碑式的作品,引領未來三到五年內有關eccDNA研究的新方向。
云序生物作為高通量技術科研服務產品推廣的先行者,向各位研究者隆重推薦最新eccDNA-seq產品,該產品做為業內率先發布的eccDNA測序服務,緊扣科研時代脈搏,緊跟前沿步伐,更快、更好、更新的滿足科研工作者在自己研究領域內對于eccDNA的探索,歡迎新老客戶來電咨詢。
云序生物染色體外環狀DNA測序技術服務:
云序生物提供染色體外環狀DNA測序服務(eccDNA-seq),利用核酸酶對線性DNA水解獲得純凈的環狀DNA,不僅檢測到的有效數據量高,還能夠深入分析在特定腫瘤癌癥中相關eccDNA的特異表達、基因組分布以及拷貝變異等,從而幫助客戶快速找到癌癥、腫瘤機理研究和診斷的靶向eccDNA。
云序優勢
國內率先提供該服務的測序公司:
通過長期的摸索,率先開發出成熟的測序流程,成為國內目前率先提供該服務的測序公司。
富集效率高:
染色體外環狀DNA的富集效率是決定數據質量的關鍵,云序生物精心優化和研發的實驗流程,具有極高的富集效率和特異性。
識別率高:
專業的生物信息學團隊,通過優化的算法能夠高效識別染色體外環狀DNA。
一站式服務:
客戶只需提供細胞、組織或基因組DNA,云序生物為您完成從樣品準備、環狀DNA富集、文庫制備、上機測序到數據分析的整套服務流程。
云序生物相關產品推薦
云序生物往期回顧
顛覆性發現:癌基因竟不在染色體上---環狀DNA連登Nature,Cell!
circRNA和m6A再次秀恩愛攜手登上Nature Communication
“雨露均沾”---- RNA甲基化“搭訕”成熟miRNA又出新花樣
胖紙的福音!敲除Zfp217基因可通過RNA m6A帶走你腰間的“救生圈”
占領C位!云序生物解析如何做到快速同時檢測各類癌癥當中RNA甲基化相關酶&RNA甲基化水平(下)
Nature | SMAD2/3與TGF-β通路協同影響轉錄因子發生m6A RNA甲基化調控干細胞發育
Nat. commun | Mettl3介導的m6A RNA甲基化調控骨髓間充質干細胞和骨質疏松癥的命運
Nature | m6A RNA甲基化識別蛋白YTHDF1參與記憶的形成
RNA甲基化已經火成這樣子了,你還在等什么!云序生物最新m6A“RNA甲基化”研究匯總—癌癥篇
Genome research:不同RNA m5C甲基化修飾存在巨大差異
上海云序生物科技有限公司
Shanghai Cloud-seq Biotech Co., Ltd.
地址:上海市松江區莘磚公路 518 號 20 號樓 3 樓
電話:021-64878766
傳真:021-64878766
網址:www.cloud-seq.com.cn
郵箱:market@cloud-seq.com.cn





