新手須知的qPCR操作技巧(上篇)
實時熒光定量 PCR(qPCR)自問世以來,就受到了廣大生命科學實驗工作者和醫院檢驗工作者的極大關注,使得該技術得到了很快的普及。雖然qPCR技術目前應用方向十分廣泛,但是仍碰到很多用戶在實驗中存在著由于不當操作而數據精度不高、重復性差、可信度差等問題。在這里,我們根據實際工作中的經驗以及參考萬謙等人[1]的研究,給大家詳細說明一些有助于提高實驗質量的操作技巧,希望能給大家帶來一定的幫助。
1、引物的操作技巧:
使用引物設計軟件進行設計時,在操作界面上設定相應的參數,擴增子參數一般設定范圍為80 ~ 200bp,擴增子長度越短,擴增效率越高,可選擇設定在110bp,110bp在后期的擴增中僅用10s,其余的參數均默認,軟件即給出引物列表,一般選用評分高或者靠前的,因為評分越高或越靠前的引物對形成引物二聚體的可能越小。
對于引物設計有疑惑,可觀看深藍云直播課“引物探針的設計和設計軟件的介紹”,點擊圖片進入直播課堂哦。(可點擊下方圖片到直播課)

引物一般由試劑公司合成,為干粉狀態,在溶解前,最好用高速離心機低溫快速離心30s,使得引物干粉匯聚到管底,避免損失引物。引物收到后,需要先摸索引物的退火溫度和終濃度,以達到較理想的qPCR擴增效果,其次測定引物的擴增效率,通常在非正式實驗時,假定引物的擴增效率為100%,擴增產物在指數期呈現2n的增長。在正式實驗時,考慮到引物的擴增效率實際不是100%,所以需要測定引物的擴增效率以修正結果。一個測定引物擴增效率的簡單方法如下: 以cDNA樣品或標準品為模板,依次稀釋 101、102、103、104、105、106 倍,采用前期摸索好的qPCR擴增條件,得到6個Cq值,然后以log(模板濃度)為X軸變量,以Cq值為Y軸變量作回歸直線圖,得到直線的斜率,擴增效率 = 10( -1 /斜率) - 1,整個數據計算可以在Excel中完成,也可在qPCR軟件中直接得出。
2、反應體系配制技巧:
正式實驗時,每個樣本至少3個重復,為了消除各重復之間的系統誤差,可配置3.2個反應體系,將所需的所有試劑和模板加在同一個PCR管中,充分渦旋混勻后,再分裝到3個重復孔中,這樣可有效減小系統誤差。另外,一些實驗者為了節省試劑,采用10μL反應體系,我們認為這是不可取的,因為體積太小,加樣誤差會大,這樣做得不償失,建議使用20μL以上的反應體積。如上操作,可以在較大程度上消除由于加樣不準造成的系統誤差。
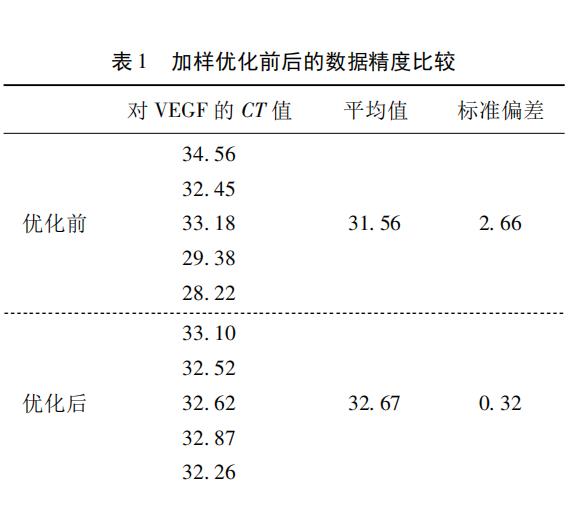
如表1所列,“優化前”是5管中分別依次加入模板和各反應試劑,最后得到的Cq值標準偏差為2.66;“優化后”是使用模板和各反應試劑的混合液,然后分裝至5管中,最后得到的Cq值標準偏差為0. 32;由上述可見,數據精度得到極大的改善。
Azure Cielo™實時熒光定量PCR系統
Azure Cielo™實時熒光定量PCR系統來自于美國Azure Biosystems公司,配備高品質溫度模塊,采用光纖和CMOS的檢測系統,高能LED的激發,提供高靈敏和可靠的數據。

▲ Azure Cielo™實時熒光定量PCR系統
參考文獻:
[1]萬謙, 陸華. 實時熒光定量PCR的一些操作技巧[J]. 實驗科學與技術, 2012(S2):189-190.