單細胞測序在腫瘤免疫治療中的應用
上周我們分享了《從單個細胞入手的腫瘤研究》,這周我們接著聊聊從單細胞入手怎樣幫助解析黑色素瘤免疫檢查點抑制劑治療不良事件的發生機制,并發現潛在治療靶點。
腫瘤免疫治療是目前該領域最具前景的發展方向之一。隨著PD-(L)1、CTLA-4等免疫檢查點抑制劑應用范圍逐漸擴大,對復發、難治性腫瘤患者表現出了突破性療效,給更多腫瘤患者帶來希望。然而近60%的PD-(L)1、CTLA-4聯合治療患者出現嚴重的毒性反應等不良事件。腸道炎癥 (checkpoint inhibitor induced colitis,+CPI colitis)是最常見的不良事件,也是停止治療的重要原因。我們目前對其發生及發展的機制仍不清楚,如果能夠找到應對的方法將會大大提高免疫檢查點抑制劑的受益群體。
這篇發表在《cell》上題為“Molecular Pathways of Colon Inflammation Induced by Cancer Immunotherapy”的文章是如何開展相關研究的呢?
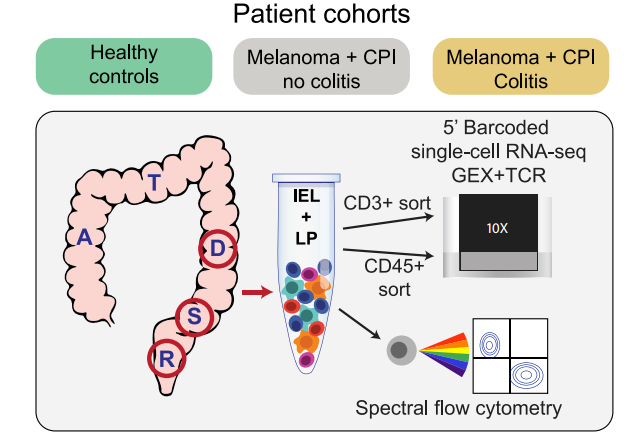
文章對黑色素瘤免疫檢查點抑制劑治療引發腸道炎癥組、治療無不良事件對照組、正常對照組對照的腸穿刺樣本(n = 6 +CPI colitis, n = 5 +CPI no colitis, n = 5 control),解離單細胞懸液后分別分選CD45+(白細胞)和CD3+(T細胞)免疫細胞,進行5’轉錄組+免疫組庫單細胞測序(圖1),通過單細胞數據的分析交出了完美的答卷。

腫瘤免疫治療是目前該領域最具前景的發展方向之一。隨著PD-(L)1、CTLA-4等免疫檢查點抑制劑應用范圍逐漸擴大,對復發、難治性腫瘤患者表現出了突破性療效,給更多腫瘤患者帶來希望。然而近60%的PD-(L)1、CTLA-4聯合治療患者出現嚴重的毒性反應等不良事件。腸道炎癥 (checkpoint inhibitor induced colitis,+CPI colitis)是最常見的不良事件,也是停止治療的重要原因。我們目前對其發生及發展的機制仍不清楚,如果能夠找到應對的方法將會大大提高免疫檢查點抑制劑的受益群體。
這篇發表在《cell》上題為“Molecular Pathways of Colon Inflammation Induced by Cancer Immunotherapy”的文章是如何開展相關研究的呢?
文章對黑色素瘤免疫檢查點抑制劑治療引發腸道炎癥組、治療無不良事件對照組、正常對照組對照的腸穿刺樣本(n = 6 +CPI colitis, n = 5 +CPI no colitis, n = 5 control),解離單細胞懸液后分別分選CD45+(白細胞)和CD3+(T細胞)免疫細胞,進行5’轉錄組+免疫組庫單細胞測序(圖1),通過單細胞數據的分析交出了完美的答卷。

圖1:實驗設計思路圖
CD45+抗體分選后進行單細胞測序分析發現,+CPI colitis組中非常顯著的T細胞和髓系細胞富集,而Control組和+CPI no colitis組具有較高的相似性,這表明T細胞群體的這些變化與疾病狀態相關,而不是藥物治療。流式細胞計數對結果進行驗證。

圖2:CD45+T細胞單細胞測序亞群分析
接下來對CD3+抗體分選細胞進行單細胞測序,更精準地分析,CD8+T細胞組成在+CPI colitis組與兩個對照組之間有顯著差異,具有高度細胞毒性和增殖狀態的CD8+T細胞大量堆積。并用流式細胞分析及多色免疫熒光在不同層面進行了驗證。同樣對CD4+T細胞群體也進行了分析,+CPI colitis組與兩個對照組相比,同樣存在特異性大量富集的細胞亞群。調節T細胞(regulatory T cells,Treg)是一群具有負調控免疫反應的淋巴細胞,之前有研究在小鼠模型中發現,抗CTLA-4免疫治療能夠導致Treg細胞的耗竭,據此推論免疫治療不良事件的產生可能與Treg細胞的耗竭有關。而本研究在對CD4+T細胞的分析發現,FoxP3+ Treg細胞比例和FoxP蛋白表達量在+CPI colitis樣本中均有顯著提升。Treg細胞亞群分析也識別出了+CPI colitis特異性的具有Th1細胞活性的Treg細胞亞群。這表明免疫檢查點抑制劑引起的腸道炎癥不是由Treg細胞耗竭導致的,炎性微環境影響了Treg細胞的表達譜。進一步對腸道炎癥相關T細胞和髓系細胞中特異表達基因進行了分析,INFr和TNFa應答基因顯著富集。

圖3:CD8+T細胞單細胞測序亞群分析及流式、多色免疫熒光驗證

圖4:CD4+T細胞單細胞測序亞群分析及流式
進一步對CD8+T細胞不同亞群的TCR克隆擴增進行分析,發現+CPI colitis組與兩個對照組之間也存在顯著差異,腸道炎癥相關CD8+T細胞有很大一部分來自于組織駐留記憶T細胞。

圖5:CD8+T細胞單細胞免疫組庫測序克隆擴增分析
通過單細胞轉錄組及免疫組庫數據揭示了腸道炎癥這一不良事件的分子發生機制,那么我們據此再找到潛在治療靶點就完美了。
通過對前面得到的數據分析揭示趨化因子受體抑制劑、aEb7 、 a4b7整合抑制劑、TNFa阻斷劑、IL-1b阻斷劑等均提示具有改善腸道炎癥的潛力。如趨化因子受體基因CXCR6在+CPI colitis組的T細胞中高表達,被IFN和TNF信號通路調控的CXCR6配體基因CXCL16在髓系細胞和肥大細胞中也同樣高表達。并且CXCR6在多種人類腫瘤細胞中都高表達,故以CXCR6作為潛在的治療靶點,或可有效改善腸道炎癥。
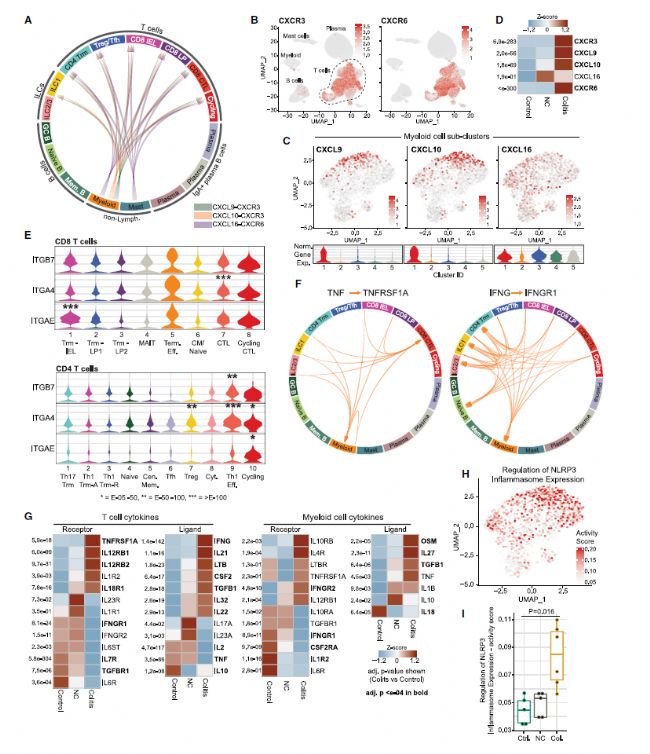
圖6:T細胞-髓系細胞的連接及治療靶標分析
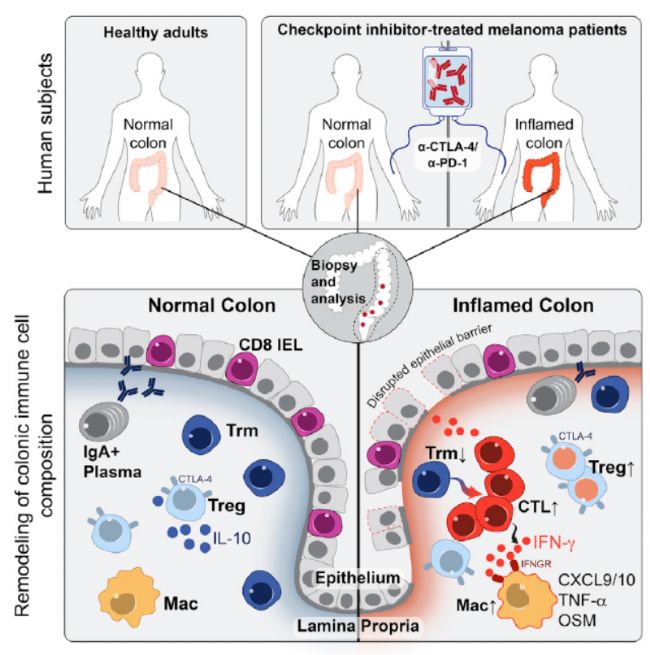
文章首次通過單細胞視角對免疫治療誘導腸炎組和免疫治療、正常人兩組對照的腸穿刺樣本,分別分選免疫細胞進行單細胞測序,揭示了免疫治療誘導腸炎的分子發生機制,具有高度細胞毒性和增殖狀態的CD8+T細胞的大量堆積,且沒有調節性T細胞耗竭的證據。TCR序列分析發現腸炎相關CD8+T細胞有很大一部分來自于組織駐留記憶T細胞,這解釋了免疫治療開始后腸炎一般較早發作。對細胞因子,趨化因子,表面受體的分析發現他們可以作為免疫檢查點阻斷引起腸炎的治療靶標。
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





