核酸藥物前沿方向:CAR-T、靶向mRNA、自擴增mRNA及環狀RNA
關于LNPs合成設備 —— 微流控設備,在實際應用中已長期證明其在合成方面的優異性能。為發掘其更多的使用價值,我們聚焦在了核酸藥物發展更前沿的領域。本期,小編將從四個方面介紹核酸藥物發展的前沿方向。分別為:CAR-T細胞治療、靶向mRNA治療、自擴增mRNA治療和環狀RNA治療。
CAR-T細胞治療
CAR-T細胞—嵌合抗原受體(CAR)細胞,是將免疫T細胞在體外進行基因重編程,使其表達能夠識別病變細胞上特定抗原的受體蛋白。此外,也可將T細胞靶向抗體修飾在LNPs表面,在體內產生短暫有效的CAR - T細胞。兩種制備方式有著相同的優異特性,即大大提升了T細胞的靶向性。CAR-T細胞治療對于多種疾病的醫治都有了實質性的突破,如白血病(1)、心臟纖維化(2)。
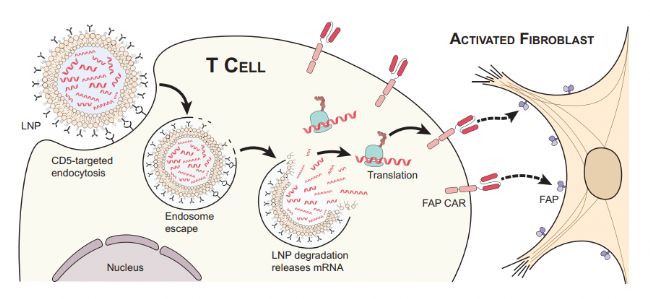
圖1.CAR-T細胞靶向過程圖
因其技術難度高、治療風險大、費用昂貴,CAR-T治療仍然作為其他常規治療方法無效后的最后手段。
靶向mRNA治療
mRNA治療的諸多優勢在上期內容中我們已經介紹過,然而,在其優勢背后還存在著一個較大的難題:靶向性。負載mRNA的LNPs被各種類型的細胞(特別是靜脈注射的肝細胞)內吞,對于除肝臟以外的器官幾乎沒有靶向能力等問題,成為了mRNA藥物多器官治療最大的障礙。
有研究表示,可以將PV1(3)作為靶點,將表面修飾的LNPs靶向肺部。檢測結果表明,肺部的mRNA得到了預期的有效表達,這也證實了靶向遞送mRNA到肺部是一種治療肺部疾病的有效方法。同樣的靶向肺部,改變遞送方式是否可行呢?答案是肯定的。有肺纖維化小鼠模型研究表明,mRNA-LNP的肺部吸入(4),成功的改善了小鼠的肺部功能。因此,肝臟外器官的靶向功能并非不可實現,找準位點、用對方式則可逐步攻破這一難題。
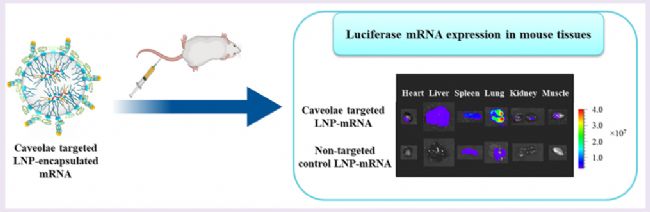
圖2.小鼠肺部靶向檢測圖
自擴增mRNA治療
自擴增mRNA(sa-mRNA)疫苗與普通mRNA疫苗最大的區別在于,其包含單鏈RNA的基因工程復制子,不僅能提供制造蛋白質的指令,還可以提供擴增mRNA 的指令。這也就這意味著,在同等條件下,使用更低的劑量,便可達到相同的免疫效果。
經過多年的科學探索,早期跡象表明sa-mRNA可用于預防和治療包括流感在內的多種傳染病。使用劑量小,免疫原性低等特點也吸引著更多的企業進行布局和研究。
環狀RNA治療
環狀mRNA是近年來新興的研究領域。與線性mRNA不同,環狀RNA是高度穩定的,共價閉合的環狀結構可以保護它免受外切酶介導的降解。有最新研究表明,SARS-CoV-2(5)環狀RNA疫苗可以在小鼠脾臟內誘導強烈的T細胞免疫應答,而進一步的研究更是顯示,該環狀RNA疫苗能夠對恒河猴產生有效保護。
盡管環狀RNA疫苗具有熱穩定性好、編碼抗原表達量高以及適用性廣泛等優點,但僅有少數的環狀RNA被證明可以作為蛋白質翻譯模板,這也給其未來的研發及應用增添了較大的難度。結論:專注于行業及市場的前沿方向,方能盡早行動,占據未來的主動優勢。以上四個前沿方向藥物的制備,我們的微流控設備皆能起到助力作用,為科研直至生產的全流程提供優質服務。
參考文獻
1. Melenhorst JJ, Chen GM, Wang M, Porter DL, Chen C, Collins MA, Gao P, Bandyopadhyay S, Sun H, Zhao Z, Lundh S, Pruteanu-Malinici I, Nobles CL, Maji S, Frey NV, Gill SI, Tian L, Kulikovskaya I, Gupta M, Ambrose DE, Davis MM, Fraietta JA, Brogdon JL, Young RM, Chew A, Levine BL, Siegel DL, Alanio C, Wherry EJ, Bushman FD, Lacey SF, Tan K, June CH. Decade-long leukaemia remissions with persistence of CD4+ CAR T cells. Nature. 2022 Feb 2. doi: 10.1038/s41586-021-04390-6. Epub ahead of print. PMID: 35110735.
2. Rurik JG, Tombácz I, Yadegari A, Méndez Fernández PO, Shewale SV, Li L, Kimura T, Soliman OY, Papp TE, Tam YK, Mui BL, Albelda SM, Puré E, June CH, Aghajanian H, Weissman D, Parhiz H, Epstein JA. CAR T cells produced in vivo to treat cardiac injury. Science. 2022 Jan 7;375(6576):91-96. doi: 10.1126/science.abm0594. Epub 2022 Jan 6. PMID: 34990237.
3. Li Q, Chan C, Peterson N, Hanna RN, Alfaro A, Allen KL, Wu H, Dall'Acqua WF, Borrok MJ, Santos JL. Engineering Caveolae-Targeted Lipid Nanoparticles To Deliver mRNA to the Lungs. ACS Chem Biol. 2020 Apr 17;15(4):830-836. doi: 10.1021/acschembio.0c00003. Epub 2020 Mar 13. PMID: 32155049.
4. Zhang R, Jing W, Chen C, Zhang S, Mohamed M, Sun P, Wang G, You W, Yang Z, Zhang J, Tang C, Du W, Liu Y, Li X, Liu J, You X, Hu H, Cai L, Xu F, Dong B, Liu M, Qiang B, Sun Y, Yu G, Wu J, Zhao K, Jiang X. Inhaled mRNA nanoformulation with biogenic ribosomal protein reverses established pulmonary fibrosis in a bleomycin-induced murine model. Adv Mater. 2022 Feb 11:e2107506. doi: 10.1002/adma.202107506. Epub ahead of print. PMID: 35146813.
5. Qu, Liang, Zongyi Yi, Y. Shen, Liangru Lin, Feng Chen, Yiyuan Xu, Zeguang Wu, Hongxia Tang, Xiaoxue Zhang, Feng Tian, Chunhui Wang, Xia Xiao, Xiaojing Dong, Li Guo, Shuaiyao Lu, Chengyun Yang, Cong Tang, Yun Yang, Wenhai Yu, Junbin Wang, Yanan Zhou, Qingrui Huang, Ayijiang Yisimayi, Yunlong Cao, Youchun Wang, Zhuo Zhou, Xiaozhong Peng, Jianwei Wang, Xia Xie and Wensheng Wei. “Circular RNA Vaccines against SARS-CoV-2 and Emerging Variants.” bioRxiv (2021): n. pag.
納米藥物制備系統

應用范圍
聯系我們:
電話:021-37827858、13818273779(微信同號)
郵箱:info@nuohailifescience.com
地址:上海市松江區順慶路650號1幢102、202室





