熒光定量PCR實驗中熒光標記的選擇詳解
熒光定量PCR技術是將常規的PCR和熒光檢測技術相結合,利用熒光信號積累實時監測整個PCR進程,以此實現對初始模板的定量分析。熒光定量PCR技術作為當今生物學研究的重要手段之一,在基礎科學、生物技術、醫學研究、法醫學、診斷學等多方面具有廣泛的應用前景。
說到熒光定量PCR技術,我們經常會問類似于“你的實驗是染料法還是探針法”,“你用的探針是什么類型”等之類的問題,這其實是對熒光標記的選擇。根據熒光標記的不同,可以將熒光定量PCR實驗分為探針法和染料法兩大類。
染料法
染料法利用能與DNA雙鏈結合的染料來實現,如SYBR Green I。該染料在游離狀態下呈現微弱的熒光,一旦與雙鏈DNA的雙螺旋小溝結合,其綠色熒光增強約1000倍。因此其總的熒光強度與雙鏈DNA含量成正比,利用這一關系可以反映生成的PCR產物的量(圖 1)。SYBR Green I的最大吸收約在497 nm,發射波長最大約在520 nm,與FAM熒光分子的光譜性質類似,因此在所有的熒光定量PCR設備中都是第一通道檢測,即“FAM/SYBR Green I”通道。
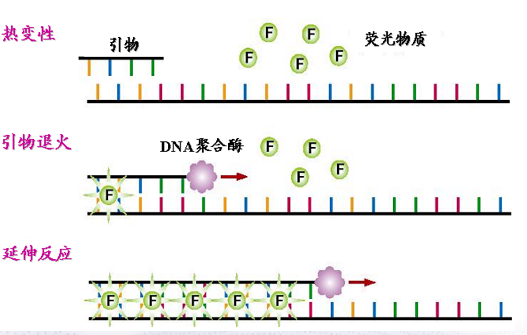
▲ 圖1 染料法原理圖
理論上,所有能與雙鏈DNA結合的染料都可以用于qPCR檢測,如溴化乙錠EtBr,碘化丙啶PI,吖啶橙、Cy3等。而選擇用于qPCR反應的染料通常會從信號強度、生物安全性、檢測簡便性和經濟適用性這幾個因素考慮。例如EtBr可能存在潛在的致癌性。綜合考慮下來,SYBR Green I成了比較理想的選擇。目前,使用Evagreen的實驗者也越來越多,Evagreen作為一種新型的染料,其光譜性質與SYBR Green I類似,其優勢在于:
▶ 對PCR反應的抑制程度小。高濃度SYBR Green I會強烈抑制PCR反應,因此要控制其使用濃度,一定程度上降低了DNA檢測的靈敏度。
▶ 與DNA結合密度高。單位長度的DNA雙鏈上Evagreen的密度更高,為飽和型染料,消除了SYBR Green I存在的“染料重分布”的缺陷,提高檢測靈敏度的同時也可用于高分辨率溶解曲線HRM。
▶ 化學性質更穩定,適合長期保存。
TaqMan 探針
TaqMan 探針基本可以滿足60%以上的qPCR實驗,如常規的基因表達和拷貝數變異CNV實驗。TaqMan 熒光探針是一種寡核苷酸探針,熒光基團連接在探針的5'末端,而淬滅劑則在3'末端(圖2)。PCR擴增時在加入一對引物的同時加入一個特異性的熒光探針,探針完整時,報告基團發射的熒光信號被淬滅基團吸收; PCR擴增時, Tag酶的5'-3'外切酶活性將探針酶切降解,使報告熒光基團和淬滅熒光基團分離,從而熒光監測系統可接收到熒光信號,每擴增一條DNA鏈,就有一個熒光分子形成,實現了熒光信號的累積與PCR產物形成完全同步。常用的熒光基團是FAM,TET,VIC,HEX。
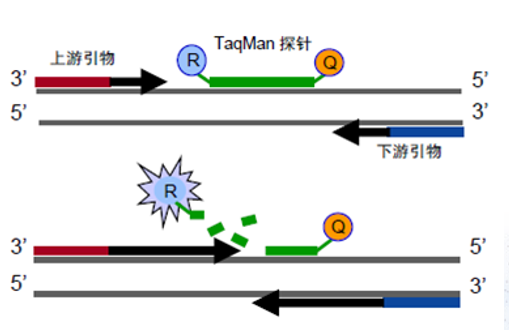
▲ 圖2 Taqman探針
MGB探針
對于要分辨單堿基差異的SNP實驗,采用對堿基錯配容忍度更低的MGB探針,在淬滅基團后加入了DPI3基團(圖3),從而提高了與靶標結合的親和力;而且可以對靶點堿基進行化學修飾,如PeptideNucleic Acid和Locked Nucleic Acid。
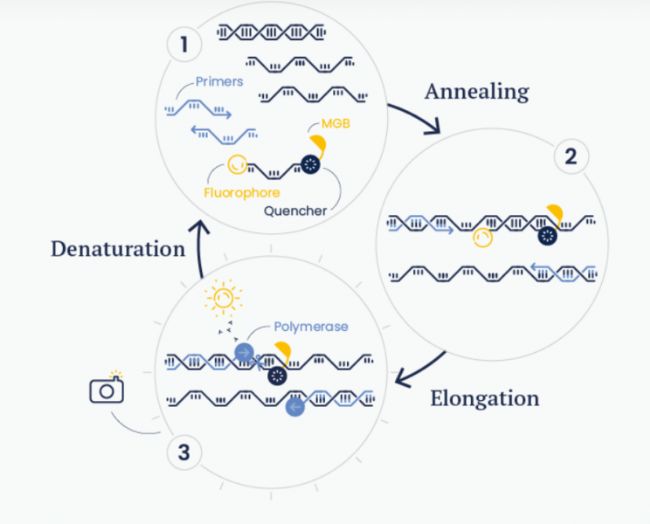
▲ 圖3 MGB探針
雙雜交探針
Taqman探針對探針的長度有比較嚴格的要求,雙雜交探針則消除了這一“缺陷”。雙雜交探針是由兩條寡核苷酸單鏈組成,一條的3’端帶有供體熒光分子,另一條的5’端帶有受體熒光分子(圖4)。游離狀態下熒光供體會發出熒光,但當兩條單鏈都匹配到模板鏈上時,就會發生熒光共振能量轉移FRET,受體熒光分子就可以發出熒光,其熒光強度與生成的產物的量成正比。雙雜交探針的優勢有兩點:擺脫了探針長度的限制,較長的探針可以提高與模板匹配的成功率;只有上下游兩條探針都正確匹配后才能檢測到受體熒光分子發出的熒光,特異性有所提高。
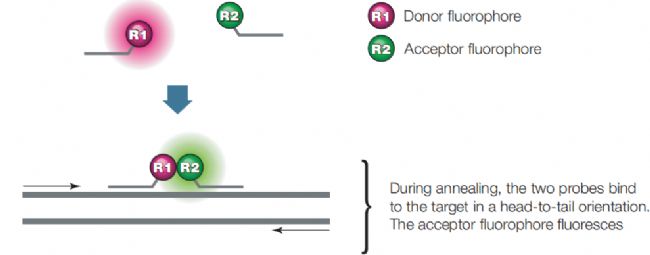
▲ 圖4 雙雜交探針
分子信標探針
游離狀態下,分子信標探針是一種莖環結構,其環狀部分的15-30個堿基可以與靶標區域相結合匹配,下端的配對區域(左右一般各5-6個堿基)則由重復的GC組成,從而將5’的熒光分子和3’的淬滅基團緊緊聚在一起,熒光發生淬滅;當退火時,分子信標探針解開環并與模板靶標雜交,這樣熒光分子和淬滅基團的物理距離就變大了,熒光淬滅的前提就打破了(圖5)。除了MGB探針,分子信標探針也非常適合用于SNP檢測。
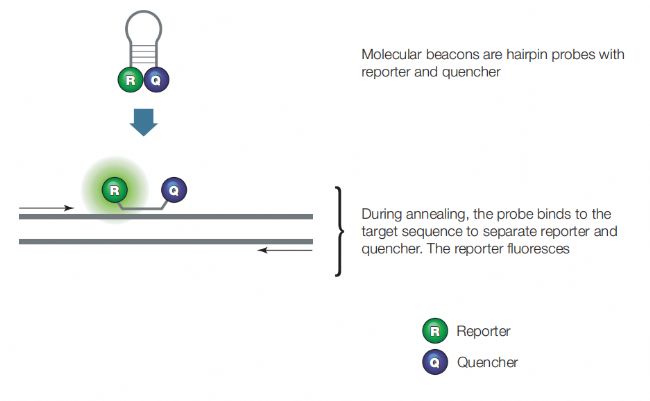
▲ 圖5 分子信標探針
除了上述幾種類型的探針之外,還有嘗試將引物和探針功能相結合的技術,如Amplifluor、LUX等,在設計難度上有所提高,但使用時更簡便。各有其應用的側重點和設計上的利弊,在此不多贅述。那么在熒光定量PCR實驗中,我們應該如何進行選擇呢?在這里,給大家總結了一些兩種方法的區別,供大家參考。
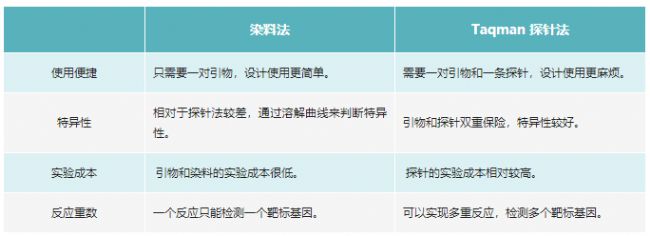
表1 染料法和探針法的區別