小鼠基礎知識九:認識四環素誘導型Cre-lox系統
在上一講中,J博士介紹了依賴tamoxifen誘導型CreER重組酶系統,它能夠幫助我們實現空間與時間雙重特異性調控基因的目的。
內容回顧:小鼠基礎知識八|J博士進階教學,Tamoxifen誘導型cre
今天,J博士帶領大家學習另外一種可逆的四環素誘導型Cre-lox系統,又可被稱為Tet on/off系統。
本篇內容重點:
● 什么是Tet on/off 系統
● 小鼠中如何應用Tet on/off系統
● Tet on/off誘導系統優點和常用品系
● Dox給藥方式
感興趣的同學們記得關注「杰克森實驗室」微信公眾號,超多知識點,千萬不要錯過喲~
01
什么是Tet on/off系統
四環素(Tetracycline,Tet)誘導系統是由E.coli大腸桿菌中Tn10轉座子改造而來,可依賴四環素進行可逆地調控基因表達。
如下圖所示,該系統在大腸桿菌中由四環素阻遏蛋白(Tet repressor, TetR)和Tet操縱子(Tet operator, TetO)組成。
● 在缺乏四環素(Tc)或其衍生物強力霉素(dox)的情況下,TetR二聚體與TetO結合,阻斷基因表達(左圖)。
● 當Tc或dox與TetR結合時,誘導TetR構象變化,導致其與TetO分離并促進基因表達(右圖)。
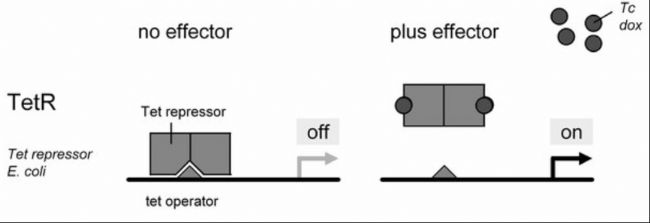
四環素調控系統原理[1]
利用TetR阻遏蛋白和TetO DNA元件可以在依賴Dox作用下進行可逆結合的原理,研究者開發出適用于真核生物的調控系統。將TetR與單純皰疹病毒(HSV)VP16蛋白轉錄激活區域融合使其起到增強子的功能。并將TetO改造為弱啟動子,只有與TetR增強子相結合才可調控下游基因表達的正常表達。
如下圖所示:TetR被改造為存在Dox的情況下,分別起到結合或不接合TetO兩種效果,即Tet on/off系統。
● Tet on系統中,tetR被改為rtTA,在Dox存在條件下,可以與tetO結合開啟下游基因表達,因此為Tet on系統;
● Tet off系統中,tetR被改造為tTA,其與Dox結合后從TetO元件上解離下來,關閉基因表達,因此為Tet off系統。
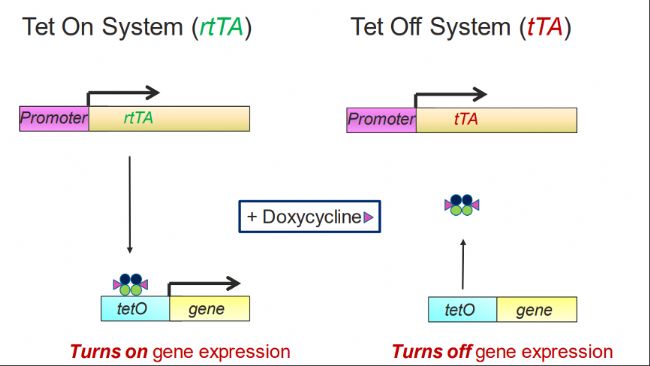
02 小鼠中如何應用Tet on/off系統
以Tet on為例,在小鼠中通常將rtTA元件和tetO元件分別構建在不同的小鼠品系當中,而rtTA可以在不同的啟動子下驅動,以達到特異性組織誘導的功能。兩個小鼠品系配繁的后代,即可通過Dox給藥或去藥,達到在特異組織中可逆調控基因表達的目的。
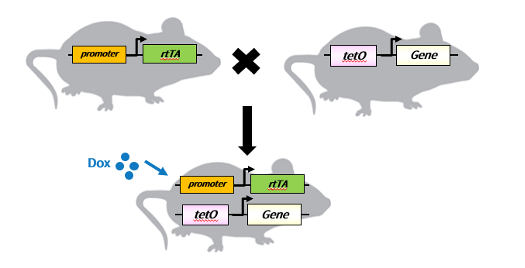
此外,Tet on/off系統還可以與cre-lox系統聯合使用,利用強大的cre工具小鼠庫,不需要重新構建rtTA/tTA小鼠即可實現在廣泛的組織中進行可逆調控基因表達。
比如:我們先利用Pdx1-cre小鼠和帶有LSL元件的rtTA floxed小鼠配繁,使其后代在胰腺表達rtTA蛋白。再將這個小鼠與攜帶tetO元件的Kras*G12D小鼠配繁,其后代小鼠就可以在Dox誘導下調控Kras*G12D蛋白的表達了。
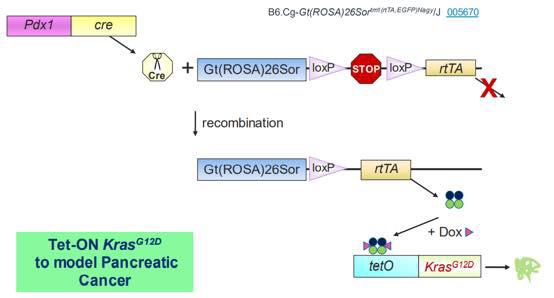
03 Tet on/off誘導系統優點和常見品系
● 精準性:藥物劑量及誘導時間可控,無內源干擾
● 可逆性:去除Dox后系統即關閉,并可反復多次誘導
● 靈敏性:低劑量,即可獲得高效率結果
● 便捷性:使用食物或飲水給藥,即可取得良好效果
04 Dox給藥方式
● 飲水 :用水制成100倍的Dox 20 mg/mL的儲備溶液。在小鼠設施中,配置成最終濃度為200微克/毫升的溶液。最好使用琥珀色的水瓶,因為Dox對光敏感。
● 飲食:食物中的Dox可由飼料公司進行定制,每kg飼料中加入200 mg Dox。在食物中可以添加食用色素,有助于追蹤哪些小鼠在服用DOX。
● 腹腔注射:10 mg Dox在0.5mL水中可以作為一次IP注射,僅針對病重的小鼠(如無法自主飲食的小鼠)。
需要注意的是,不同基因工程小鼠對于Dox的響應是有區別的,最好還是參考所關心的小鼠品系的相關文獻,并且在開展自己的實驗前,根據實驗目的進行條件摸索。
參考文獻:
[1] van Til NP, Markusic DM, van der Rijt R, Kunne C, Hiralall JK, Vreeling H, Frederiks WM, Oude-Elferink RP, Seppen J. Kupffer cells and not liver sinusoidal endothelial cells prevent lentiviral transduction of hepatocytes. Mol Ther. 2005 Jan;11(1):26-34.





