循環伏安法測試金屬在溶液中的電化學反應的方法介紹
循環伏安法指控制研究的電勢以恒定的速度從初始電勢掃描到反向電勢,改變掃描方向,以相同的速度掃描回到初始電勢,電勢繼續反向,反復掃描,記錄下來的電流-電勢曲線稱為循環伏安線。
循環伏安法具有操作簡單、獲取信息較多、可進行理論分析等特點,在電化學研究中得到了廣泛的應用。通過循環伏安曲線分析可以得到較多的信息,利用峰值電流進行定量分析,可判斷電極過程的可逆性,對未知的電化學體系進行電化學行為的探討。例如,可以通過陰、陽極峰值電勢差Δφ的絕對值及其隨著掃描速度v的變化對電極過程可逆性進行判斷。
為了測量金屬在溶液中進行電化學反應產生的微變電流,可使用循環伏安法進行測定。將化學阻抗分析儀SE1106中的恒電勢儀接入溶液中,Ag棒作為工作電極作為研究的對象,輔助電極為了是使工作電極上電流暢通,參比電極可以避免溶液本身帶來的極化影響,使用上位機設定一定周期的鋸齒波來獲取循環伏安線。
以銀絲在KOH溶液進行電化學反應測量循環伏安曲線為例,學習使用循環伏安法研究電極電化學行為。銀絲電極在7 mol·L-1KOH溶液中的循環伏安曲線如圖1所示,其中電極電勢為型對于同溶液中Hg/HgO電極的電勢,記為φ vs. Hg/HgO。
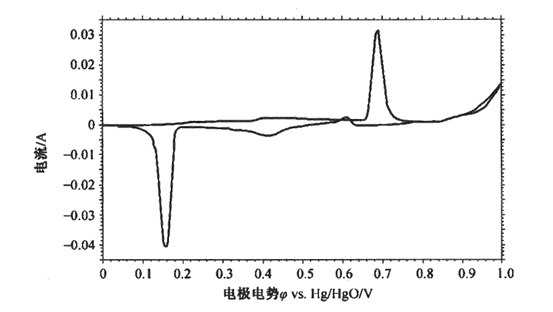
圖1.電極電勢φ vs. Hg/HgO/V
曲線前半段電流隨電壓緩慢是上升,出現了比較低且平緩的電流峰,這是表面金屬Ag氧化為Ag2O的陽極電流峰。當電勢掃描至0.25V時,曲線繼而出現低而平緩的電流峰,由于Ag具有良好的導電性,反應產生的Ag2O膜覆蓋了Ag表面上,導致電極導電性下降,阻礙了反應的進行。當電勢掃描至0.65V時,曲線出現了明顯的陽極電流峰, Ag2O反應產生轉化為電阻率極低的AgO,電阻極化迅速下降,極化電流迅速增大。當電勢掃描至0.8V時,溶液中有氣泡逸出,OH-在電勢作用下產生O2,這時為O2析出的電流。
電勢從1V掃描至0.6V時,開始出現了陰極電流峰,這是AgO還原為Ag2O所至,由于Ag2O的電阻率遠比AgO高,隨反應進行出現了較小的陰極電流峰。電勢掃描至0.2V時,出現了第二個陰極電流峰,這是Ag2O還原為Ag所至,此時極化較大,這與AgO導電性很差有關。電流峰的出現,是因為Ag2O逐漸轉化為導電性良好的Ag,迅速改善了電機的導電性,電流上升至很高的數值。
由此可見,通過循環伏安曲線可以看出電極上可進行何種電化學反應,反應可能以何種速度進行,反應具備什么特征,反應可能受到哪些因素影響等,從而探討體系的電化學特性。
因此,在研究一個位置體系時,常常首先采用循環伏安法進行定性的分析。





