機械誘導的細胞代謝破壞了SAOS-2骨肉瘤細胞的氧化應激穩態
Mechano-induced cell metabolism disrupts the oxidative stress homeostasis of SAOS-2 osteosarcoma cells
Keywords: cyclic stretch; mechanobiology; metabolomics (LC-MS); osteosarcoma; oxidative stress response.
人體不斷受到物理力的影響,這些力會改變決定細胞行為的分子特性。在實體瘤進展過程中,細胞會經歷維持遷移的機械和代謝變化。然而,關于細胞的代謝狀態如何影響其惡性特征,反之亦然,目前知之甚少。
骨肉瘤(OS)是最普遍的原發性骨腫瘤。OS細胞的機制生物學研究發現,它們響應于幾種細胞外力學刺激的變化來調節其惡性腫瘤。研究已經確定了細胞外信號與化療失敗之間的密切聯系,設想了細胞外刺激可以調節細胞毒性的可能。骨微環境已被證明在OS的發生、進展和復發中起著至關重要的作用。鑒于已知大多數化療藥物會增加細胞內活性氧(ROS)的濃度,并可能破壞癌細胞內的氧化還原平衡,因此,機械力有助于細胞中的細胞毒性過程是一個合理的假設。通常,大多數癌細胞中發生的代謝改變被認為有助于腫瘤發展,并介導對化療藥物的耐藥性,尤其是,OS中細胞代謝的改變,這已經被報道與OS惡性腫瘤的等級相關。
基于此,意大利圖西亞大學生態與生物科學系和羅馬第二大學臨床科學與轉化醫學系的課題團隊在一項研究中利用一種機械方案(24 h,1 Hz,0.5% 伸長率的循環拉伸),通過使用非靶向質譜方法確定SAOS-2 細胞中機械力誘導的代謝改變。由于幾種機械刺激被報道通過多種機制增加自由基(如活性氧和氮)的產生,代謝組學分析也集中在氧化應激穩態的機械調節上。此外,對參與氧化應激防御的一些機械敏感的細胞保護基因如SOD1,SIRT1,FOXO1和Nrf2的表達水平進行了比較分析,并確認了機械誘導的代謝變化是否有助于骨肉瘤SAOS-2細胞對化療藥物阿霉素誘導的死亡變得更加敏感。研究成果發表在 Frontiers in Molecular Biosciences 期刊題為“Mechano-induced cell metabolism disrupts the oxidative stress homeostasis of SAOS-2 osteosarcoma cells”。

將人骨肉瘤 SAOS-2 細胞暴露于特定的中等幅度單軸循環拉伸應變方案(1 Hz,0.5%,24h),進行非靶向代謝組學分析以評估由這種機械刺激誘導的細胞代謝變化。火山圖分析表明,與未刺激的 SAOS-2 細胞(Ctrl對照)相比,機械拉伸細胞中有 48 種代謝物顯著下調,25 種代謝物顯著上調,主要表現為甘氨酸、谷氨酸、谷氨酰胺、天冬氨酸、精氨酸和賴氨酸等氨基酸的變化。氨基酸水平的增加表明其在循環拉伸細胞的能量產生和核苷酸合成中起著核心作用。
為了詳細研究單軸循環拉伸對能量代謝的機械調控,比較了暴露于或未暴露于0.5%伸長率單軸循環拉伸24 h的SAOS-2細胞的糖酵解(EMP)、戊糖磷酸途徑(PPP)和三羧酸循環(TCA)。結果觀察到,機械拉伸細胞中葡萄糖-6-磷酸(G6P)豐度的增加(圖1),乳酸積累顯著減少,證實了循環拉伸應用可以逆轉 SAOS-2 細胞中的 Warburg 效應(指癌細胞代謝優先采用糖酵解代謝而不是氧化磷酸化代謝以生成能量)。由于PPP和EMP 在代謝上有關聯,共享共同的中間產物G6P,糖酵解的增加同時導致PPP速率降低,反之亦然。正如預期的那樣,這強調了 1 Hz 刺激的細胞中葡萄糖從EMP 轉移到 PPP 中。
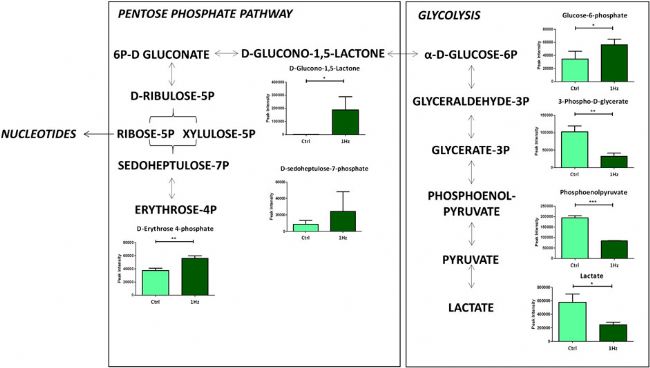
圖1 與對照(Ctrl)相比,機械刺激(1 Hz)樣本中屬于糖酵解和磷酸戊糖途徑的中間體積累的變化。
與未處理的細胞相比,拉伸刺激的 SAOS-2 細胞中,在一些單個氨基酸濃度水平及其相關途徑的水平上也檢測到顯著差異,如谷胱甘肽代謝的下調。轉硫途徑對谷胱甘肽的產生有顯著貢獻,它涉及將源自蛋氨酸和葉酸循環產生的同型半胱氨酸轉化為半胱氨酸,再通過一系列途徑生成谷胱甘肽。有趣的是,研究結果顯示,與對照組相比,拉伸細胞中與蛋氨酸循環有關的代謝物下調(圖2)。
除上述氨基酸外,絲氨酸和甘氨酸也是這些代謝所必需的。絲氨酸轉化為甘氨酸的過程涉及維生素B6 作為必需輔酶。這些途徑分別對核苷酸合成和甲基供體 S-腺苷甲硫氨酸(SAM)的生成很重要。因此,觀察到的機械誘導的絲氨酸、甘氨酸和維生素 B6 的生物活性形式的上調,使研究人員能夠假設這些代謝物不會通過葉酸循環供給蛋氨酸循環。相對于靜態組,拉伸刺激細胞中 SAM 和 S-腺苷同型半胱氨酸水平的降低也證實了這一假設,因此它們不參與核苷酸合成和 GSH 的產生。
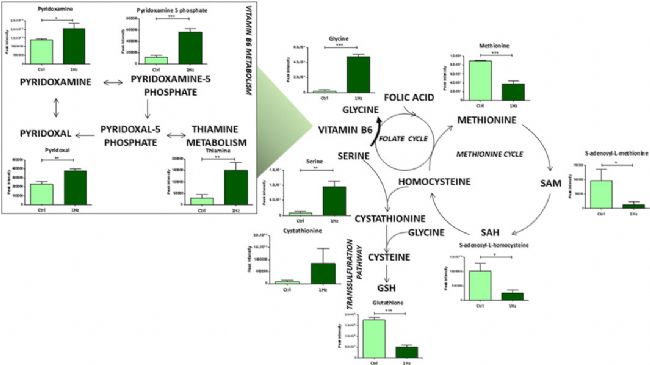
圖2 機械誘導的氨基酸和維生素B6代謝的中間體積累的變化。
由于代謝組學分析顯示了機械處理的 SAOS-2 細胞中氧化應激增加的幾個顯著特征,因此,實驗評估了 24 h+1 Hz 機械刺激是否伴隨著細胞間 ROS 的產生。與靜態對照相比,機械刺激誘導了1.89倍的ROS 過量生成(圖3 A)。為了評估機械和化學刺激對 ROS 生成的協同作用,將拉伸預處理的細胞與 ROS 誘導劑阿霉素(一種目前用于骨肉瘤治療的化療藥物)一起孵育。同時進行的機械和化學刺激顯示,ROS的生成增加;8.6 μM阿霉素處理SAOS-2-細胞24小時后ROS生成增加5倍(圖3 A)。因此,化學誘導的ROS生成掩蓋了SAOS-2細胞中靜態和拉伸誘導的ROS生成調節之間的差異。
基于取得的結果,實驗還假設拉伸誘導的氧化應激穩態的破壞可能導致機械預處理的 SAOS-2 細胞發生細胞毒性致敏。因此,采用阿霉素來測試骨肉瘤細胞對死亡的抵抗力,用1.25-10 μM范圍內不同濃度的阿霉素處理預拉伸和對照細胞。結果發現,在兩種情況下,SAOS-2 細胞都以劑量依賴性方式死亡(圖3 B),然而,預拉伸細胞的死亡率更高。這表明,1 Hz+24 h拉伸處理可使骨肉瘤細胞對阿霉素誘導的死亡更敏感。
由于 SOD1、SIRT1、Nrf2 和 FOXO-1 是機械敏感基因,在對抗氧化應激中起重要作用,因此使用實時 PCR 測量了其基因表達水平。結果表明,24 h+1 Hz 機械刺激沒有顯著干擾 FOXO1 的表達水平,但誘導了 SOD1 基因的上調,并同時下調了轉錄因子基因 SIRT1 和 Nrf2表達水平。這些結果表明,1 Hz 拉伸處理增加了細胞ROS生成和SAOS-2細胞對阿霉素的敏感性。
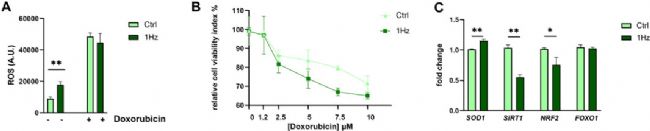
圖3 機械誘導的SAOS-2細胞系活性氧和細胞毒性的上調。
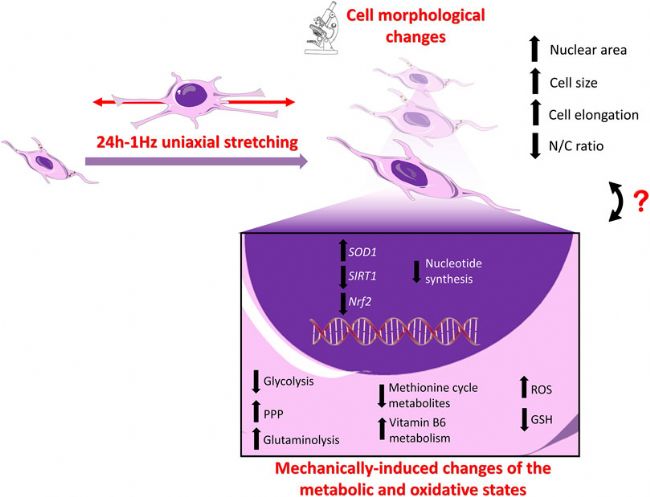
圖4 SAOS-2 細胞中拉伸誘導變化的示意圖:上圖。細胞形態:整個細胞在循環拉伸應變后伸長率增加,導致 SAOS-2 細胞的大小顯著增加,細胞核質比(N/C)破壞。下圖:基因表達水平:雖然成骨分化標志物(即 ALP、COL1、RUNX-2)的表達水平不受機械刺激的影響,但目前數據顯示與未刺激的細胞相比,機械刺激的細胞中 SIRT1 和 Nrf2 下調,SOD1 上調。代謝狀態:機械刺激與Warburg效應的逆轉、谷氨酰胺代謝的上調、GSH耗竭、細胞內ROS積累和PPP的上調有關,同時與核苷酸合成的下調有關。
總之,目前基于LC-MS的代謝組學分析顯示,在機械1 Hz刺激后,SAOS-2細胞中的代謝物發生了不同的顯著改變。通路分析表明,機械刺激細胞的能量代謝被破壞,其特征是糖酵解和三羧酸循環顯著下調,但氨基酸代謝也失調(即谷氨酰胺分解增強,蛋氨酸循環減少)。反過來,在機械誘導的 GSH 耗竭和 ROS 富集的支持下,研究數據表明,機械拉伸處理可以誘導氧化應激穩態水平的增加,從而使 SAOS-2 細胞對阿霉素誘導的細胞死亡敏感。這些發現有助于細致地了解SAOS-2細胞對機械刺激的復雜反應,為細胞行為、轉移和對治療藥物敏感性的潛在影響提供了有價值的見解。
參考文獻:Fanelli G, Alloisio G, Lelli V, Marini S, Rinalducci S, Gioia M. Mechano-induced cell metabolism disrupts the oxidative stress homeostasis of SAOS-2 osteosarcoma cells. Front Mol Biosci. 2024 Apr 25;10:1297826. doi: 10.3389/fmolb.2023.1297826. PMID: 38726050; PMCID: PMC11079223.
原文鏈接:https://pubmed.ncbi.nlm.nih.gov/38726050/
Impact Factor 5.0
Electronic ISSN 2296-889X
圖片來源:所有圖片均來源于參考文獻
小編旨在分享、學習、交流生物科學等領域的研究進展。如有侵權或引文不當請聯系小編修正。如有任何的想法以及建議,歡迎聯系小編。感謝各位的瀏覽以及關注!進入官網www.naturethink.com或關注"Naturethink"公眾號,了解更多相關內容。
點擊了解: 細胞牽張力裝置
點擊了解:牽張應變細胞培養儀
點擊了解:細胞張應力(應變)刺激實驗系統





