ChIP-seq等揭示Foxo1-YAP-Notch1軸在疾病進展中的表觀調控作用
大家好,這里是專注表觀組學十余年,領跑多組學科研服務的易基因。
非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)是一種慢性肝臟疾病,其特征是肝臟中脂肪積累、炎癥和纖維化。干擾素基因刺激因子(stimulator of IFN genes,STING)是一種細胞質DNA傳感器,與NASH中的炎癥激活有關。先天免疫激活對于NASH進展期間引發肝臟炎癥至關重要,然而免疫調節分子如何識別脂肪生成、纖維化和炎癥信號的機制尚不清楚。
2024年8月9日,上海交通大學醫學院附屬仁濟醫院肝臟外科徐東偉博士、Xiaoye Qu、Tao Yang為并列第一作者,徐東偉博士和美國加州大學洛杉磯分校大衛格芬醫學院Bibo Ke為共同通訊作者研究了高脂飲食(high-fat diet,HFD)誘導的氧化應激如何激活肝細胞中的Foxo1、YAP和Notch1信號,并研究這些信號如何影響NASH進展。相關研究成果以“The Foxo1-YAP-Notch1 axis reprograms STING-mediated innate immunity in NASH progression”為題發表在《experimental and molecular medicine》雜志(EXP MOL MED)(IF 9.5)。

本研究揭示高脂飲食(HFD)誘導的氧化應激激活了肝巨噬細胞中的Foxo1、YAP和Notch1信號。巨噬細胞Foxo1缺失(Foxo1M-KO)改善了HFD肝臟中的肝炎、脂肪肝和纖維化,減少了HFD肝臟中STING(stimulator of IFN genes)、TBK1(TANK-binding kinase 1)和NF-κB的激活。但Foxo1和YAP雙基因敲除(Foxo1/YAPM-DKO)或Foxo1和Notch1雙基因敲除(Foxo1/Notch1M-DKO)促進了STING功能,并加劇HFD誘導的肝損傷。而Foxo1M-KO顯著降低了棕櫚酸(PA)和油酸(OA)刺激的Kupffer細胞釋放的TGF-β1,并在與Kupffer細胞共培養后的原代肝星狀細胞(HSCs)中介導Col1α1、CCL2和Timp1表達下調,但上調MMP1表達。Kupffer細胞中PA和OA增強了LIMD1和LATS1的共定位和互作,從而誘導YAP核轉位。Foxo1M-KO激活了PGC-1α并增加了細胞核YAP活性,調節線粒體生物合成。研究利用染色質免疫沉淀測序(ChIP-Seq)以及原位RNA雜交,揭示了NICD與YAP共定位并靶向Mb21d1(cGAS),而YAP作為NICD的新輔助激活因子,對于NASH進展中STING功能的重編程至關重要。這些發現強調了巨噬細胞Foxo1–YAP–Notch1軸作為一個關鍵分子調控因子的重要性,該軸可以調控NASH中的脂質代謝、炎癥和先天免疫。
實驗方法:
使用基因敲除小鼠模型,通過24周高脂飲食喂養后,利用ChIP-seq、RNA-seq、RNA原位雜交、Western blot等方法研究了Foxo1、YAP和Notch1在巨噬細胞中的特異性敲除對肝臟病理變化的影響。
結果圖形:
(1)巨噬細胞中Foxo1敲除減少高脂飲食(HFD)誘導的肝臟脂肪變性和炎癥反應。
為鑒定巨噬細胞Foxo1是否參與肝臟脂肪變性,研究分析了脂肪肝中Kupffer細胞的Foxo1表達。通過Western blot、免疫熒光染色、組織學染色、定量PCR等實驗研究結果表明,巨噬細胞中Foxo1缺失可以減少高脂飲食誘導的脂肪變性和炎癥反應。Foxo1在調控肝臟脂肪積累和炎癥過程中的作用表明巨噬細胞Foxo1在NASH的發生和發展中起著至關重要的作用,而調節Foxo1活性或表達可能為治療NASH提供一種新策略。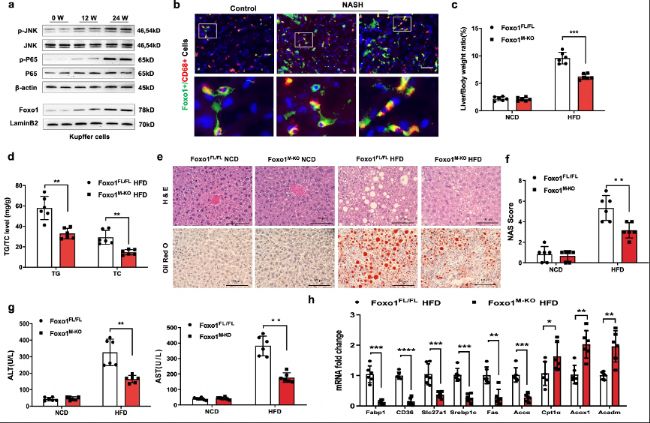
圖1:巨噬細胞Foxo1缺失減少了高脂飲食誘導的NASH中的肝臟脂肪變性和炎癥。
a. 在野生型(WT)小鼠被喂食高脂飲食(HFD)24周后,通過western blot分析揭示肝臟巨噬細胞中的核Foxo1、p-JNK、JNK、p-P65和P65蛋白表達上調。
b. 免疫熒光染色顯示脂肪肝中巨噬細胞Foxo1表達增加(每組n=6個樣本)。
c. Foxo1M-KO小鼠表現出較低的肝臟與體重比(每組n=6個樣本)。
d. Foxo1M-KO肝臟中肝甘油三酯(TG)和總膽固醇(TC)水平(每組n=6個樣本)降低。
e. 代表性的組織學染色(H&E和Oil Red O)顯示Foxo1M-KO減輕肝臟脂肪變性,并減少肝細胞氣球樣變和脂質積累(每組n=6個樣本)。
f. 基于組織學圖像檢測的NAS(NAFLD活動評分)在Foxo1M-KO組中顯著降低(每組n=6個樣本)。
g. HFD喂養的Foxo1M-KO小鼠血清ALT和AST水平降低(IU/L)(每組n=6個樣本)。
h. 定量PCR顯示,脂肪肝中負責脂肪酸攝取和合成的基因Srebp1c、Slc27a1、Fabp1、CD36、Fas和Accα的水平顯著降低,而Cpt1α、Acox1和Acadm表達增加(每組n=6個樣本)。
(2)巨噬細胞Foxo1缺失抑制了 STING 介導的 HFD型NASH肝臟炎癥和纖維化
接下來研究人員分析了巨噬細胞 Foxo1 是否影響 HFD 誘導NASH 中的 STING 激活和肝纖維化。數據結果表明,巨噬細胞Foxo1信號對于調控HFD誘導的NASH中STING介導的肝臟炎癥和纖維化至關重要。
b. 免疫熒光染色顯示,在Foxo1M-KO小鼠經過24周的HFD喂養后,肝臟中CD11b陽性巨噬細胞減少(每組n=6個樣本)。
c. 定量RT-PCR顯示,在Foxo1M-KO小鼠經過24周的HFD喂養后,TNF-α、IL-1β、IL-6和CXCL-10水平降低,而IL-10的水平在Foxo1M-KO小鼠中增加(每組n=6個樣本)。
d. 代表性的組織學和免疫組化染色(Sirius Red、Masson和α-SMA)顯示Foxo1M-KO小鼠的HFD肝臟中肝纖維化減少(每組n=6個樣本)。
e. 定量RT-PCR顯示脂肪肝中Foxo1M-KO小鼠的α-SMA、Col1a1、CCL2和Timp1表達減少(每組n=6個樣本)。
f. 肝臟Kupffer細胞先用0.2 mM棕櫚酸(PA)和0.4 mM油酸(OA)混合物刺激24小時,然后與原代肝星狀細胞(HSCs)共培養。與Foxo1FL/FL相比,Foxo1M-KO顯著減少了PA/OA刺激的巨噬細胞在共培養上清中TGF-β1的釋放(每組n=4個樣本)。
g. 共培養后發現HSC水平的Col1α1、CCL2、Timp1 mRNA減少,MMP1增加(每組n=4個樣本)。
(3)巨噬細胞Foxo1敲除促進Notch1和Hippo信號通路響應HFD
接下來,作者研究了巨噬細胞Foxo1是否影響對響應HFD的基因表達和信號通路。對照組Foxo1FL/FL和敲除組Foxo1M-KO小鼠經過24周HFD喂養后,從小鼠中分離出肝臟巨噬細胞,并進行深度RNA測序(RNA-seq)分析。分析結果表明,與Foxo1FL/FL對照組相比,Foxo1M-KO組HFD巨噬細胞中912個基因表達發生顯著變化(415個上調和497個下調)(圖3a)。GO分析顯示Foxo1M-KO中與炎癥反應、先天免疫反應、細胞脂質代謝過程等多個基因表達發生變化(圖3b,c)。KEGG分析揭示了與Notch信號通路、脂肪酸代謝、PPAR信號通路、AMPK信號通路、Hippo信號通路及細胞因子-細胞因子受體互作相關的基因表達的富集(圖3d,e)。Notch1和Hippo信號通路相關基因,如Hes1、Hey1、Fosl1、Ccnd1、Nr4a2、Ccnb1和Erbb2,在HFD喂養的Foxo1M-KO動物的巨噬細胞中顯著激活,且通過定量RT-PCR進一步驗證。這些結果表明Notch1和Hippo通路在調節巨噬細胞Foxo1驅動的NASH進展中發揮著重要作用。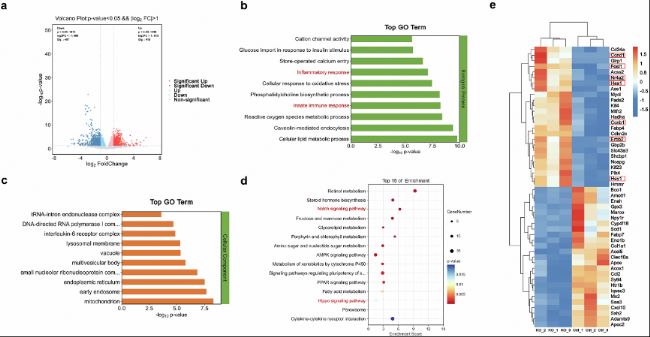
圖3:巨噬細胞中Foxo1敲除在響應高脂飲食(HFD)時促進了Notch1和Hippo信號通路。Foxo1FL/FL和Foxo1M-KO小鼠經過24周HFD喂養后,從它們的肝臟巨噬細胞中提取了總RNA,隨后進行RNA-seq。
a. Foxo1M-KO小鼠與Foxo1FL/FL對照組相比,在HFD肝臟巨噬細胞中的基因表達的log2倍數變化。HFD肝臟巨噬細胞中的差異表達基因(DEGs)(n=912,P<0.05)被標記出來(紅色表示上調,n=415;綠色表示下調,n=497)。
b-c. Foxo1M-KO小鼠的HFD肝臟巨噬細胞的GO富集分析,包括細胞成分和生物過程。
d. KEGG通路富集分析,分析了Foxo1M-KO小鼠的HFD肝臟巨噬細胞中差異表達的轉錄本。
e. Foxo1M-KO小鼠的HFD肝臟巨噬細胞中表達變化的基因熱圖。
(4)巨噬細胞Foxo1敲除在HFD誘導的氧化應激中增加了YAP/NICD活性并抑制STING激活
由于Hippo通路及其效應蛋白YAP(一個轉錄輔激活因子),已被確認為調控基因功能的重要信號級聯,作者隨后研究了HFD誘導的氧化應激是否影響NASH進展中的YAP和Notch1的細胞內域(NICD)。
a. HFD喂養后,巨噬細胞中的核YAP和NICD表達顯著增加。
b. 從WT小鼠中分離的肝臟巨噬細胞用0.2 mM棕櫚酸(PA)和0.4 mM油酸(OA)混合物刺激24小時。PA/OA刺激激活了JNK,并增加了巨噬細胞中核Foxo1和PGC-1α的表達。
c. PA和OA刺激增加了p-LATS1和LIMD1表達,導致巨噬細胞中細胞質YAP磷酸化減少和核YAP表達增加。
d. 免疫熒光染色顯示PA/OA刺激的巨噬細胞中巨噬細胞LIMD1(綠色)和LATS1(紅色)的共定位。
e. 免疫共沉淀分析顯示PA/OA刺激增強了巨噬細胞中LIMD1和LATS1的共定位和互作。
f. WT小鼠的肝臟巨噬細胞在PA/OA刺激后轉染CRISPR/Cas9介導的LIMD1 KO或對照載體。此外LIMD1 KO增加了細胞質YAP磷酸化并減少核YAP表達。
g. 巨噬細胞Foxo1敲除顯著增加了PGC-1α、YAP和NICD水平,并在PA/OA刺激后下調p-STING表達。
h. Foxo1M-KO小鼠的肝臟巨噬細胞在PA/OA刺激后轉染CRISPR/Cas9介導的PGC-1α KO或對照載體。免疫共沉淀分析揭示Foxo1M-KO細胞中CRISPR/Cas9介導的PGC-1α KO減少了YAP與NICD互作并增加p-STING表達。
(5)YAP-NICD互作靶向cGAS并調節STING介導的炎癥
HFD誘導的氧化應激增加了JNK依賴性Foxo1轉錄活性和LIMD1介導的YAP核轉位,并激活Notch1信號,作者進一步研究其中的潛在分子機制。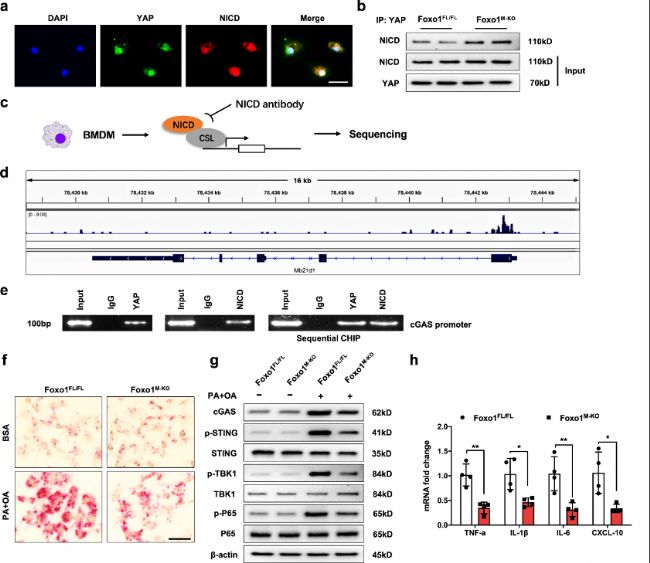
圖 5:YAP–NICD互作靶向cGAS并調節STING介導的炎癥。
a. 免疫熒光染色顯示,在PA/OA刺激后巨噬細胞核內YAP(綠色)和NICD(紅色)的共定位。
b. 免疫共沉淀分析顯示,Foxo1敲除增加了YAP與Foxo1M-KO巨噬細胞中NICD的結合。
c. NICD ChIP-seq分析的實驗設計。骨髓源性巨噬細胞(bone marrow-derived macrophages,BMMs)在與PA/OA共培養24小時后收集并固定。在染色質剪切和NICD抗體選擇后,沉淀的DNA片段由NICD蛋白復合物進行測序。
d. 在小鼠Mb21d1(cGAS)基因上的NICD結合位點的定位。顯示了9號染色體上小鼠cGAS基因的5個外顯子、4個內含子、3'非翻譯區(UTR)、5'UTR和轉錄起始位點(TSS)。
e. NICD和YAP與cGAS啟動子結合的ChIP-PCR分析。
f. RNA原位雜交分析顯示,在PA/OA刺激后Foxo1FL/FL巨噬細胞中目標基因cGAS的轉錄表達增加(每組n=4個樣本)。
g. 脂肪酸刺激增加了Foxo1FL/FL或Foxo1M-KO小鼠的PA刺激的Foxo1FL/FL巨噬細胞中cGAS、p-STING、p-TBK1和p-P65的表達,而Foxo1敲除減少了cGAS、p-STING、p-TBK1和p-P65的表達。
h. qRT-PCR分析顯示,在暴露于PA/OA的巨噬細胞中TNF-α、IL-1β、IL-6和CXCL-10水平降低(每組n=4個樣本)。
ChIP-seq分析揭示了YAP–NICD軸靶向cGAS并調節對PA/OA刺激的STING介導的炎癥反應。
(6)HFD誘導的NASH中巨噬細胞Notch1信號通路破壞激活了cGAS并增加STING介導的肝臟炎癥和纖維化。
為了闡明Notch激活在巨噬細胞Foxo1信號介導的NASH免疫調節中的作用機制,作者制備了骨髓特異性Foxo1和Notch1雙敲除(Foxo1/Notch1M-DKO)小鼠。
圖6:巨噬細胞Notch1信號通路的破壞激活了cGAS并增加了HFD誘導的NASH中STING介導的肝臟炎癥和纖維化。
a. 24周HFD喂養后,Foxo1/Notch1M-DKO增加了脂肪肝中cGAS、p-STING、p-TBK1、p-P65以及核PGC-1α、LIMD1和YAP的表達。
b. 免疫熒光染色顯示Foxo1/Notch1M-DKO增加了脂肪肝中CD11b陽性巨噬細胞的積累(每組n=6個樣本)。
c. Foxo1/Notch1M-DKO增加了脂肪肝中TNF-α、IL-1β、IL-6和CXCL-10的表達,并降低了IL-10水平(每組n=6個樣本)。
d. HFD喂養的Foxo1/Notch1M-DKO小鼠的肝臟/體重比顯著增加(每組n=6個樣本)。
e. HFD喂養的Foxo1/Notch1M-DKO小鼠的TG和TC(mg/g)脂質水平顯著增加(每組n=6個樣本)。
f. 代表性組織學染色(H&E和Oil Red O)顯示HFD喂養的Foxo1/Notch1M-DKO小鼠的肝臟表現出增加的脂質積累(每組n=6個樣本)。
g. 基于組織學圖像檢測的NAS(NAFLD活動評分)在Foxo1/Notch1M-DKO組顯著增加(每組n=6個樣本)。
h. HFD喂養的Foxo1/Notch1M-DKO小鼠的血清ALT和AST水平增加(IU/L)(每組n=6個樣本)。
i. 代表性的組織學和免疫組化染色(Sirius Red和Masson)顯示Foxo1/Notch1M-DKO小鼠的脂肪肝組織中肝纖維化增強(每組n=6個樣本)。
j. 在HFD喂養后,Foxo1/Notch1M-DKO肝臟中包括αSMA、Col1α1、TGF-β1、CCL2和TIMP1在內的促纖維化基因的mRNA表達增加(每組n=6個樣本)。
Foxo1/Notch1M-DKO激活了cGAS,增加了STING介導的炎癥反應,并加劇了HFD誘導的NASH中的肝纖維化。
(7)YAP是巨噬細胞中Foxo1介導的STING功能免疫調節在脂毒性誘導的線粒體氧化應激中所必需的。 在證明了巨噬細胞YAP-NICD互作在調節HFD誘導的氧化應激中STING功能的關鍵作用之后,作者進一步在體外研究了YAP在免疫和代謝調節中的機制作用。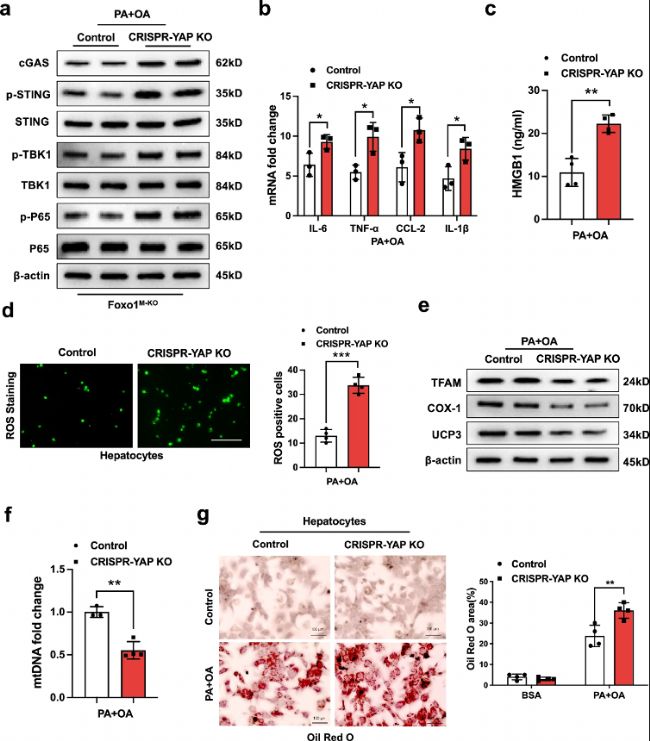
圖 7:YAP是巨噬細胞Foxo1介導的STING功能免疫調節在脂毒性誘導的線粒體氧化應激中所必需的。從Foxo1M-KO小鼠中分離的骨髓源性巨噬細胞(BMMs),轉染CRISPR/Cas9介導的YAP基因敲除(p-CRISPR-YAP KO)或對照載體,然后在與0.2 mM棕櫚酸(PA)和0.4 mM油酸(OA)混合物孵育24小時后,與原代肝細胞共培養。
a. CRISPR/Cas9介導的YAP基因敲除增強了PA刺激的巨噬細胞中cGAS、p-STING、p-TBK1和p-P65的表達。
b. 在PA和OA刺激的Foxo1M-KO巨噬細胞中,IL-6、TNF-α、CCL2和IL-β的mRNA水平升高。
c. ELISA分析顯示,在p-CRISPR-YAP-KO細胞中HMGB1的釋放顯著增加,而在對照細胞中沒有增加(每組n=4個樣本)。
d. 免疫熒光染色顯示,p-CRISPR-YAP KO在Foxo1M-KO巨噬細胞中增加了與PA/OA共培養后肝細胞的ROS產生(每組n=4個樣本)。定量ROS產生巨噬細胞(綠色)。
e. 在與p-CRISPR-YAP KO轉染的Foxo1M-KO巨噬細胞共培養后,肝細胞中TFAM、COX-1和UCP3的表達降低。
f. 定量RT-PCR分析顯示,p-CRISPR-YAP KO減少了與p-CRISPR-YAP KO或對照載體轉染的巨噬細胞共培養后肝細胞中的mtDNA水平(每組n=4個樣本)。
g. Oil Red O染色顯示,在與p-CRISPR-YAP-KO或對照載體轉染的巨噬細胞共培養后,肝細胞內細胞質脂質增加(每組n=4個樣本)。
(8)Foxo1–YAP軸調控HFD誘導的NASH中STING介導的肝臟炎癥和脂肪變性。
接下來,作者分析了Foxo1–YAP軸在調節NASH中脂質代謝和STING介導的炎癥中的作用。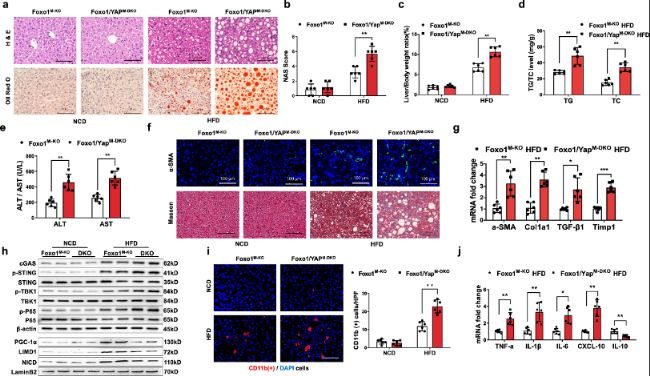
圖 8:Foxo1–YAP軸調節HFD誘導的NASH中STING介導的肝臟炎癥和脂肪變性。
a. 代表性的組織學染色(H&E和Oil Red O)顯示,Foxo1M-KO小鼠表現出脂質積累減少,而Foxo1/YAPM-DKO小鼠在24周HFD喂養后表現出肝臟脂肪變性增加(每組n=6個樣本)。
b. 基于組織學圖像測量的NAS(NAFLD活動評分)在Foxo1/YAPM-DKO組顯著增加(每組n=6個樣本)。
c. Foxo1/YAPM-DKO小鼠的肝臟/體重比顯著更高(每組n=6個樣本)。
d. Foxo1/YAPM-DKO小鼠的TG和TC水平(mg/g)顯著增加(每組n=6個樣本)。
e. Foxo1/YAPM-DKO小鼠表現出顯著增加的血清ALT和AST水平(IU/L)(每組n=6個樣本)。
f. 代表性的免疫熒光和免疫組化圖像(α-SMA和Masson)顯示Foxo1/YAPM-DKO肝臟的肝纖維化顯著增加(每組n=6個樣本)。
g. 定量RT-PCR分析顯示Foxo1/YAPM-DKO脂肪肝中cGAS、p-STING、p-TBK1和p-P65的表達上調(每組n=6個樣本)。
h. Western blot分析揭示Foxo1/YAPM-DKO在脂肪肝中cGAS、p-STING、p-TBK1和p-P65的表達增加,且核PGC-1α、LIMD1和NICD的表達增加。
i. 免疫熒光染色顯示,在缺血肝臟中CD11b陽性巨噬細胞的積累增加(每組n=6個樣本)。
j. 在脂肪肝的Foxo1/YAPM-DKO肝臟中,TNF-α、IL-1β、IL-6和CXCL-10的mRNA水平增加,而IL-10水平降低(每組n=6個樣本)。
HFD誘導的NASH小鼠Foxo1/YAPM-DKO加劇了STING介導的肝臟炎癥、脂肪變性和纖維化。
參考文獻:
Xu D, Qu X, Yang T, Sheng M, Bian X, Zhan Y, Tian Y, Lin Y, Jin Y, Wang X, Ke M, Jiang L, Li C, Xia Q, Farmer DG, Ke B. The Foxo1-YAP-Notch1 axis reprograms STING-mediated innate immunity in NASH progression. Exp Mol Med. 2024 Aug 9. pii: 10.1038/s12276-024-01280-5. doi: 10.1038/s12276-024-01280-5. PubMed PMID: 39122845.
非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)是一種慢性肝臟疾病,其特征是肝臟中脂肪積累、炎癥和纖維化。干擾素基因刺激因子(stimulator of IFN genes,STING)是一種細胞質DNA傳感器,與NASH中的炎癥激活有關。先天免疫激活對于NASH進展期間引發肝臟炎癥至關重要,然而免疫調節分子如何識別脂肪生成、纖維化和炎癥信號的機制尚不清楚。
2024年8月9日,上海交通大學醫學院附屬仁濟醫院肝臟外科徐東偉博士、Xiaoye Qu、Tao Yang為并列第一作者,徐東偉博士和美國加州大學洛杉磯分校大衛格芬醫學院Bibo Ke為共同通訊作者研究了高脂飲食(high-fat diet,HFD)誘導的氧化應激如何激活肝細胞中的Foxo1、YAP和Notch1信號,并研究這些信號如何影響NASH進展。相關研究成果以“The Foxo1-YAP-Notch1 axis reprograms STING-mediated innate immunity in NASH progression”為題發表在《experimental and molecular medicine》雜志(EXP MOL MED)(IF 9.5)。

本研究揭示高脂飲食(HFD)誘導的氧化應激激活了肝巨噬細胞中的Foxo1、YAP和Notch1信號。巨噬細胞Foxo1缺失(Foxo1M-KO)改善了HFD肝臟中的肝炎、脂肪肝和纖維化,減少了HFD肝臟中STING(stimulator of IFN genes)、TBK1(TANK-binding kinase 1)和NF-κB的激活。但Foxo1和YAP雙基因敲除(Foxo1/YAPM-DKO)或Foxo1和Notch1雙基因敲除(Foxo1/Notch1M-DKO)促進了STING功能,并加劇HFD誘導的肝損傷。而Foxo1M-KO顯著降低了棕櫚酸(PA)和油酸(OA)刺激的Kupffer細胞釋放的TGF-β1,并在與Kupffer細胞共培養后的原代肝星狀細胞(HSCs)中介導Col1α1、CCL2和Timp1表達下調,但上調MMP1表達。Kupffer細胞中PA和OA增強了LIMD1和LATS1的共定位和互作,從而誘導YAP核轉位。Foxo1M-KO激活了PGC-1α并增加了細胞核YAP活性,調節線粒體生物合成。研究利用染色質免疫沉淀測序(ChIP-Seq)以及原位RNA雜交,揭示了NICD與YAP共定位并靶向Mb21d1(cGAS),而YAP作為NICD的新輔助激活因子,對于NASH進展中STING功能的重編程至關重要。這些發現強調了巨噬細胞Foxo1–YAP–Notch1軸作為一個關鍵分子調控因子的重要性,該軸可以調控NASH中的脂質代謝、炎癥和先天免疫。
實驗方法:
使用基因敲除小鼠模型,通過24周高脂飲食喂養后,利用ChIP-seq、RNA-seq、RNA原位雜交、Western blot等方法研究了Foxo1、YAP和Notch1在巨噬細胞中的特異性敲除對肝臟病理變化的影響。
結果圖形:
(1)巨噬細胞中Foxo1敲除減少高脂飲食(HFD)誘導的肝臟脂肪變性和炎癥反應。
為鑒定巨噬細胞Foxo1是否參與肝臟脂肪變性,研究分析了脂肪肝中Kupffer細胞的Foxo1表達。通過Western blot、免疫熒光染色、組織學染色、定量PCR等實驗研究結果表明,巨噬細胞中Foxo1缺失可以減少高脂飲食誘導的脂肪變性和炎癥反應。Foxo1在調控肝臟脂肪積累和炎癥過程中的作用表明巨噬細胞Foxo1在NASH的發生和發展中起著至關重要的作用,而調節Foxo1活性或表達可能為治療NASH提供一種新策略。

圖1:巨噬細胞Foxo1缺失減少了高脂飲食誘導的NASH中的肝臟脂肪變性和炎癥。
b. 免疫熒光染色顯示脂肪肝中巨噬細胞Foxo1表達增加(每組n=6個樣本)。
c. Foxo1M-KO小鼠表現出較低的肝臟與體重比(每組n=6個樣本)。
d. Foxo1M-KO肝臟中肝甘油三酯(TG)和總膽固醇(TC)水平(每組n=6個樣本)降低。
e. 代表性的組織學染色(H&E和Oil Red O)顯示Foxo1M-KO減輕肝臟脂肪變性,并減少肝細胞氣球樣變和脂質積累(每組n=6個樣本)。
f. 基于組織學圖像檢測的NAS(NAFLD活動評分)在Foxo1M-KO組中顯著降低(每組n=6個樣本)。
g. HFD喂養的Foxo1M-KO小鼠血清ALT和AST水平降低(IU/L)(每組n=6個樣本)。
h. 定量PCR顯示,脂肪肝中負責脂肪酸攝取和合成的基因Srebp1c、Slc27a1、Fabp1、CD36、Fas和Accα的水平顯著降低,而Cpt1α、Acox1和Acadm表達增加(每組n=6個樣本)。
(2)巨噬細胞Foxo1缺失抑制了 STING 介導的 HFD型NASH肝臟炎癥和纖維化
接下來研究人員分析了巨噬細胞 Foxo1 是否影響 HFD 誘導NASH 中的 STING 激活和肝纖維化。數據結果表明,巨噬細胞Foxo1信號對于調控HFD誘導的NASH中STING介導的肝臟炎癥和纖維化至關重要。

圖2:巨噬細胞中Foxo1敲除抑制了HFD誘導的NASH中STING介導的肝臟炎癥和纖維化。
a. 在Foxo1M-KO小鼠經過24周的HFD喂養后,肝臟中p-STING、p-TBK1和p-P65的表達減少。b. 免疫熒光染色顯示,在Foxo1M-KO小鼠經過24周的HFD喂養后,肝臟中CD11b陽性巨噬細胞減少(每組n=6個樣本)。
c. 定量RT-PCR顯示,在Foxo1M-KO小鼠經過24周的HFD喂養后,TNF-α、IL-1β、IL-6和CXCL-10水平降低,而IL-10的水平在Foxo1M-KO小鼠中增加(每組n=6個樣本)。
d. 代表性的組織學和免疫組化染色(Sirius Red、Masson和α-SMA)顯示Foxo1M-KO小鼠的HFD肝臟中肝纖維化減少(每組n=6個樣本)。
e. 定量RT-PCR顯示脂肪肝中Foxo1M-KO小鼠的α-SMA、Col1a1、CCL2和Timp1表達減少(每組n=6個樣本)。
f. 肝臟Kupffer細胞先用0.2 mM棕櫚酸(PA)和0.4 mM油酸(OA)混合物刺激24小時,然后與原代肝星狀細胞(HSCs)共培養。與Foxo1FL/FL相比,Foxo1M-KO顯著減少了PA/OA刺激的巨噬細胞在共培養上清中TGF-β1的釋放(每組n=4個樣本)。
g. 共培養后發現HSC水平的Col1α1、CCL2、Timp1 mRNA減少,MMP1增加(每組n=4個樣本)。
(3)巨噬細胞Foxo1敲除促進Notch1和Hippo信號通路響應HFD
接下來,作者研究了巨噬細胞Foxo1是否影響對響應HFD的基因表達和信號通路。對照組Foxo1FL/FL和敲除組Foxo1M-KO小鼠經過24周HFD喂養后,從小鼠中分離出肝臟巨噬細胞,并進行深度RNA測序(RNA-seq)分析。分析結果表明,與Foxo1FL/FL對照組相比,Foxo1M-KO組HFD巨噬細胞中912個基因表達發生顯著變化(415個上調和497個下調)(圖3a)。GO分析顯示Foxo1M-KO中與炎癥反應、先天免疫反應、細胞脂質代謝過程等多個基因表達發生變化(圖3b,c)。KEGG分析揭示了與Notch信號通路、脂肪酸代謝、PPAR信號通路、AMPK信號通路、Hippo信號通路及細胞因子-細胞因子受體互作相關的基因表達的富集(圖3d,e)。Notch1和Hippo信號通路相關基因,如Hes1、Hey1、Fosl1、Ccnd1、Nr4a2、Ccnb1和Erbb2,在HFD喂養的Foxo1M-KO動物的巨噬細胞中顯著激活,且通過定量RT-PCR進一步驗證。這些結果表明Notch1和Hippo通路在調節巨噬細胞Foxo1驅動的NASH進展中發揮著重要作用。

圖3:巨噬細胞中Foxo1敲除在響應高脂飲食(HFD)時促進了Notch1和Hippo信號通路。Foxo1FL/FL和Foxo1M-KO小鼠經過24周HFD喂養后,從它們的肝臟巨噬細胞中提取了總RNA,隨后進行RNA-seq。
b-c. Foxo1M-KO小鼠的HFD肝臟巨噬細胞的GO富集分析,包括細胞成分和生物過程。
d. KEGG通路富集分析,分析了Foxo1M-KO小鼠的HFD肝臟巨噬細胞中差異表達的轉錄本。
e. Foxo1M-KO小鼠的HFD肝臟巨噬細胞中表達變化的基因熱圖。
(4)巨噬細胞Foxo1敲除在HFD誘導的氧化應激中增加了YAP/NICD活性并抑制STING激活
由于Hippo通路及其效應蛋白YAP(一個轉錄輔激活因子),已被確認為調控基因功能的重要信號級聯,作者隨后研究了HFD誘導的氧化應激是否影響NASH進展中的YAP和Notch1的細胞內域(NICD)。

圖4:巨噬細胞中Foxo1敲除在HFD誘導的氧化應激中增加了YAP/NICD活性并抑制STING激活。
a. HFD喂養后,巨噬細胞中的核YAP和NICD表達顯著增加。
b. 從WT小鼠中分離的肝臟巨噬細胞用0.2 mM棕櫚酸(PA)和0.4 mM油酸(OA)混合物刺激24小時。PA/OA刺激激活了JNK,并增加了巨噬細胞中核Foxo1和PGC-1α的表達。
c. PA和OA刺激增加了p-LATS1和LIMD1表達,導致巨噬細胞中細胞質YAP磷酸化減少和核YAP表達增加。
d. 免疫熒光染色顯示PA/OA刺激的巨噬細胞中巨噬細胞LIMD1(綠色)和LATS1(紅色)的共定位。
e. 免疫共沉淀分析顯示PA/OA刺激增強了巨噬細胞中LIMD1和LATS1的共定位和互作。
f. WT小鼠的肝臟巨噬細胞在PA/OA刺激后轉染CRISPR/Cas9介導的LIMD1 KO或對照載體。此外LIMD1 KO增加了細胞質YAP磷酸化并減少核YAP表達。
g. 巨噬細胞Foxo1敲除顯著增加了PGC-1α、YAP和NICD水平,并在PA/OA刺激后下調p-STING表達。
h. Foxo1M-KO小鼠的肝臟巨噬細胞在PA/OA刺激后轉染CRISPR/Cas9介導的PGC-1α KO或對照載體。免疫共沉淀分析揭示Foxo1M-KO細胞中CRISPR/Cas9介導的PGC-1α KO減少了YAP與NICD互作并增加p-STING表達。
(5)YAP-NICD互作靶向cGAS并調節STING介導的炎癥
HFD誘導的氧化應激增加了JNK依賴性Foxo1轉錄活性和LIMD1介導的YAP核轉位,并激活Notch1信號,作者進一步研究其中的潛在分子機制。

圖 5:YAP–NICD互作靶向cGAS并調節STING介導的炎癥。
b. 免疫共沉淀分析顯示,Foxo1敲除增加了YAP與Foxo1M-KO巨噬細胞中NICD的結合。
c. NICD ChIP-seq分析的實驗設計。骨髓源性巨噬細胞(bone marrow-derived macrophages,BMMs)在與PA/OA共培養24小時后收集并固定。在染色質剪切和NICD抗體選擇后,沉淀的DNA片段由NICD蛋白復合物進行測序。
d. 在小鼠Mb21d1(cGAS)基因上的NICD結合位點的定位。顯示了9號染色體上小鼠cGAS基因的5個外顯子、4個內含子、3'非翻譯區(UTR)、5'UTR和轉錄起始位點(TSS)。
e. NICD和YAP與cGAS啟動子結合的ChIP-PCR分析。
f. RNA原位雜交分析顯示,在PA/OA刺激后Foxo1FL/FL巨噬細胞中目標基因cGAS的轉錄表達增加(每組n=4個樣本)。
g. 脂肪酸刺激增加了Foxo1FL/FL或Foxo1M-KO小鼠的PA刺激的Foxo1FL/FL巨噬細胞中cGAS、p-STING、p-TBK1和p-P65的表達,而Foxo1敲除減少了cGAS、p-STING、p-TBK1和p-P65的表達。
h. qRT-PCR分析顯示,在暴露于PA/OA的巨噬細胞中TNF-α、IL-1β、IL-6和CXCL-10水平降低(每組n=4個樣本)。
ChIP-seq分析揭示了YAP–NICD軸靶向cGAS并調節對PA/OA刺激的STING介導的炎癥反應。
(6)HFD誘導的NASH中巨噬細胞Notch1信號通路破壞激活了cGAS并增加STING介導的肝臟炎癥和纖維化。
為了闡明Notch激活在巨噬細胞Foxo1信號介導的NASH免疫調節中的作用機制,作者制備了骨髓特異性Foxo1和Notch1雙敲除(Foxo1/Notch1M-DKO)小鼠。

圖6:巨噬細胞Notch1信號通路的破壞激活了cGAS并增加了HFD誘導的NASH中STING介導的肝臟炎癥和纖維化。
b. 免疫熒光染色顯示Foxo1/Notch1M-DKO增加了脂肪肝中CD11b陽性巨噬細胞的積累(每組n=6個樣本)。
c. Foxo1/Notch1M-DKO增加了脂肪肝中TNF-α、IL-1β、IL-6和CXCL-10的表達,并降低了IL-10水平(每組n=6個樣本)。
d. HFD喂養的Foxo1/Notch1M-DKO小鼠的肝臟/體重比顯著增加(每組n=6個樣本)。
e. HFD喂養的Foxo1/Notch1M-DKO小鼠的TG和TC(mg/g)脂質水平顯著增加(每組n=6個樣本)。
f. 代表性組織學染色(H&E和Oil Red O)顯示HFD喂養的Foxo1/Notch1M-DKO小鼠的肝臟表現出增加的脂質積累(每組n=6個樣本)。
g. 基于組織學圖像檢測的NAS(NAFLD活動評分)在Foxo1/Notch1M-DKO組顯著增加(每組n=6個樣本)。
h. HFD喂養的Foxo1/Notch1M-DKO小鼠的血清ALT和AST水平增加(IU/L)(每組n=6個樣本)。
i. 代表性的組織學和免疫組化染色(Sirius Red和Masson)顯示Foxo1/Notch1M-DKO小鼠的脂肪肝組織中肝纖維化增強(每組n=6個樣本)。
j. 在HFD喂養后,Foxo1/Notch1M-DKO肝臟中包括αSMA、Col1α1、TGF-β1、CCL2和TIMP1在內的促纖維化基因的mRNA表達增加(每組n=6個樣本)。
Foxo1/Notch1M-DKO激活了cGAS,增加了STING介導的炎癥反應,并加劇了HFD誘導的NASH中的肝纖維化。
(7)YAP是巨噬細胞中Foxo1介導的STING功能免疫調節在脂毒性誘導的線粒體氧化應激中所必需的。 在證明了巨噬細胞YAP-NICD互作在調節HFD誘導的氧化應激中STING功能的關鍵作用之后,作者進一步在體外研究了YAP在免疫和代謝調節中的機制作用。

圖 7:YAP是巨噬細胞Foxo1介導的STING功能免疫調節在脂毒性誘導的線粒體氧化應激中所必需的。從Foxo1M-KO小鼠中分離的骨髓源性巨噬細胞(BMMs),轉染CRISPR/Cas9介導的YAP基因敲除(p-CRISPR-YAP KO)或對照載體,然后在與0.2 mM棕櫚酸(PA)和0.4 mM油酸(OA)混合物孵育24小時后,與原代肝細胞共培養。
b. 在PA和OA刺激的Foxo1M-KO巨噬細胞中,IL-6、TNF-α、CCL2和IL-β的mRNA水平升高。
c. ELISA分析顯示,在p-CRISPR-YAP-KO細胞中HMGB1的釋放顯著增加,而在對照細胞中沒有增加(每組n=4個樣本)。
d. 免疫熒光染色顯示,p-CRISPR-YAP KO在Foxo1M-KO巨噬細胞中增加了與PA/OA共培養后肝細胞的ROS產生(每組n=4個樣本)。定量ROS產生巨噬細胞(綠色)。
e. 在與p-CRISPR-YAP KO轉染的Foxo1M-KO巨噬細胞共培養后,肝細胞中TFAM、COX-1和UCP3的表達降低。
f. 定量RT-PCR分析顯示,p-CRISPR-YAP KO減少了與p-CRISPR-YAP KO或對照載體轉染的巨噬細胞共培養后肝細胞中的mtDNA水平(每組n=4個樣本)。
g. Oil Red O染色顯示,在與p-CRISPR-YAP-KO或對照載體轉染的巨噬細胞共培養后,肝細胞內細胞質脂質增加(每組n=4個樣本)。
(8)Foxo1–YAP軸調控HFD誘導的NASH中STING介導的肝臟炎癥和脂肪變性。
接下來,作者分析了Foxo1–YAP軸在調節NASH中脂質代謝和STING介導的炎癥中的作用。

圖 8:Foxo1–YAP軸調節HFD誘導的NASH中STING介導的肝臟炎癥和脂肪變性。
b. 基于組織學圖像測量的NAS(NAFLD活動評分)在Foxo1/YAPM-DKO組顯著增加(每組n=6個樣本)。
c. Foxo1/YAPM-DKO小鼠的肝臟/體重比顯著更高(每組n=6個樣本)。
d. Foxo1/YAPM-DKO小鼠的TG和TC水平(mg/g)顯著增加(每組n=6個樣本)。
e. Foxo1/YAPM-DKO小鼠表現出顯著增加的血清ALT和AST水平(IU/L)(每組n=6個樣本)。
f. 代表性的免疫熒光和免疫組化圖像(α-SMA和Masson)顯示Foxo1/YAPM-DKO肝臟的肝纖維化顯著增加(每組n=6個樣本)。
g. 定量RT-PCR分析顯示Foxo1/YAPM-DKO脂肪肝中cGAS、p-STING、p-TBK1和p-P65的表達上調(每組n=6個樣本)。
h. Western blot分析揭示Foxo1/YAPM-DKO在脂肪肝中cGAS、p-STING、p-TBK1和p-P65的表達增加,且核PGC-1α、LIMD1和NICD的表達增加。
i. 免疫熒光染色顯示,在缺血肝臟中CD11b陽性巨噬細胞的積累增加(每組n=6個樣本)。
j. 在脂肪肝的Foxo1/YAPM-DKO肝臟中,TNF-α、IL-1β、IL-6和CXCL-10的mRNA水平增加,而IL-10水平降低(每組n=6個樣本)。
HFD誘導的NASH小鼠Foxo1/YAPM-DKO加劇了STING介導的肝臟炎癥、脂肪變性和纖維化。
參考文獻:
Xu D, Qu X, Yang T, Sheng M, Bian X, Zhan Y, Tian Y, Lin Y, Jin Y, Wang X, Ke M, Jiang L, Li C, Xia Q, Farmer DG, Ke B. The Foxo1-YAP-Notch1 axis reprograms STING-mediated innate immunity in NASH progression. Exp Mol Med. 2024 Aug 9. pii: 10.1038/s12276-024-01280-5. doi: 10.1038/s12276-024-01280-5. PubMed PMID: 39122845.
標簽:
ChIP-seq
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





