單細胞轉錄組測序揭示N7-甲基鳥苷酸(m7G)tRNA修飾減弱的致病機理

期刊:Proceedings of the National Academy of Sciences
影響因子:9.4
伯豪技術服務:單細胞核轉錄組測序、伯優®細胞核分離試劑盒
研究背景
背景:m7G甲基轉移酶復合體組分WDR4的突變在神經性疾病患者中常見,但機制不明。
科學問題:WDR4調控神經疾病的分子機制;該機制在治療中的潛在應用價值。
實驗材料:C57BL/6N小鼠、人類iPSC誘導分化成的神經元細胞。
表型:源自病人的WDR4突變導致小鼠特定類型神經元隨時間退化,進而導致小鼠神經系統發育紊亂。
機制:
1. WDR4點突變抑制WDR4和METTL1之間的互作,使得METTL1蛋白加速降解;
2. Wdr4突變使tRNA m7G修飾下調,進而下調mTOR通路相關mRNA的翻譯,引發內質網應激,上調神經元細胞凋亡;
應用:
1. TUDCA處理可以顯著緩解Wdr4突變帶來的神經元死亡,提升Wdr4突變小鼠的神經元功能;
2. AAV病毒轉導回補野生型WDR4,能夠恢復小鼠大腦METTL1蛋白及tRNA m7G修飾水平,對Wdr4突變小鼠具有長效治療效果;
3. 對具有臨床病人WDR4突變的人類iPSC誘導成的神經元細胞進行TUDCA處理和WDR4回補,細胞存活率和功能性均有顯著提升。
伯豪產品
單細胞核轉錄組測序、轉錄組測序、TRAC-seq、多核糖體測序
(單細胞和轉錄組測序服務由伯豪生物提供)
研究結果
1. WDR4突變導致發育、運動和智力缺陷
臨床上,患者常見的WDR4突變是170位的精氨酸(R)突變成亮氨酸(L),作者通過Wdr4基因的定點突變,使小鼠WDR4 215R突變為L,由此構建出WDR4臨床突變的小鼠模型(Wdr4R21L/R215L,下稱“突變小鼠”;Fig. 1A-C)。相比于野生型小鼠(Wdr4+/+),突變小鼠出現嚴重的發育遲緩,體重、體型和存活時間顯著降低(Fig. 1D-G)。另一方面,作者也對野生型和突變小鼠的運動平衡能力和認知能力進行了檢測和比較,發現8周齡的突變小鼠在上述方面均存在顯著的缺陷,而4周齡小鼠則沒有顯著差異(Fig. 1H-P)。
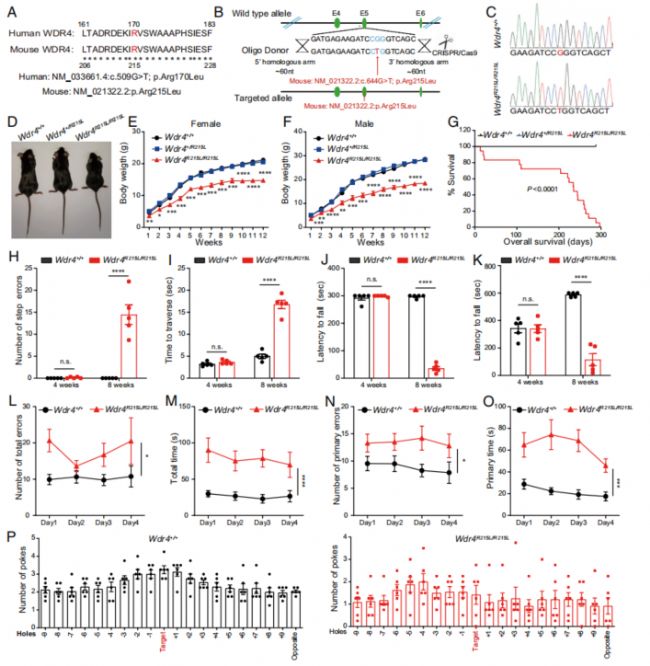
Fig. 1. Wdr4突變引起發育、動作和智力缺陷
2. WDR4點突變導致神經元細胞死亡和小頭畸形
如同臨床上的WDR4突變病人會出現小頭畸形,8周齡的突變小鼠相較于野生對照組,腦部尺寸和重量上也顯著降低,大腦皮層無顯著差異,但小腦萎縮嚴重,伴有小腦中凋亡細胞數目的顯著上調(Fig. 2A-H, L-N)。考慮到突變小鼠在4周齡沒有形態、認知和行為上的顯著缺陷,所以作者也對2周至8周之間的多個年齡時間點的小鼠小腦進行了定量分析,可見突變型小鼠的小腦萎縮表型在5周(Day 35)后開始顯現,主要體現在小腦皮層中IGL(internal granule layer,內部顆粒層)和ML(molecular layer,分子層)的面積顯著降低(Fig. 2I-K)。
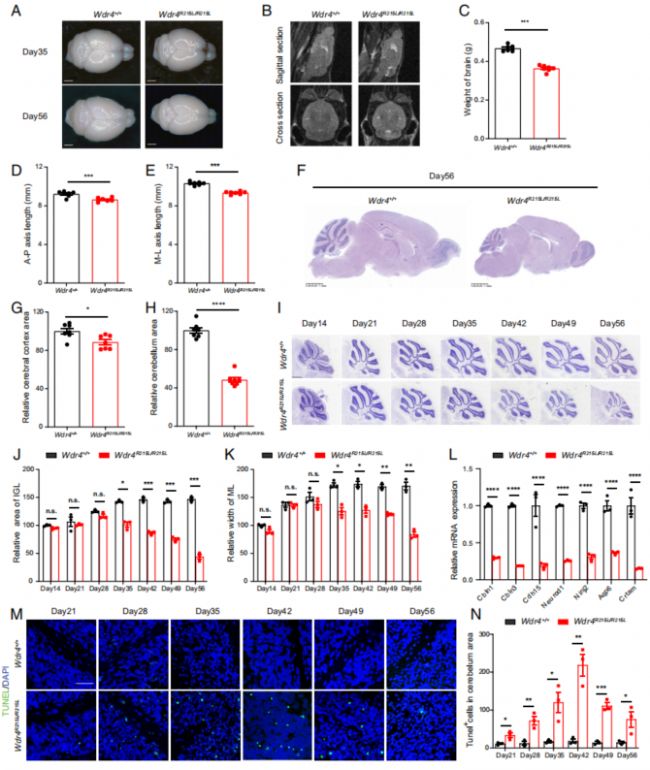
Fig. 2. WDR4點突變引起神經細胞死亡和小頭畸形
3. Wdr4突變小鼠腦部特定類型細胞隨時間退化
上述小腦萎縮的病理過程也暗示了METTL1/WDR4通過tRNA m7G調控腦部發育與穩態的機制也可能具有時序上的特征。因此,作者在野生型小鼠中檢測了1日齡至8周齡之間多個時間點的METTL1和WDR4蛋白水平,發現二者在4周(Day 28)前隨時間逐漸升高,在Day 28左右達到峰值,隨后開始逐漸下降(Fig. 3A)。
為了在單細胞水平上探究Wdr4突變帶來的影響,作者選取8周齡(Day 56)小鼠進行單細胞核測序(snRNA-seq;測序服務由伯豪生物提供),通過已知的腦部細胞marker對聚類后的數據進行了注釋,并對在數量上占絕大多數的神經元細胞進行了進一步的亞型細分與注釋(Fig. S2A, F, G; Fig. 3B)。在神經元細分成的14個亞群中,Subcluster 0在突變小鼠中幾乎消失,該細胞亞型中,顆粒層細胞marker Gabra6和Etv1特異性高表,暗示了Wdr4點突變對小腦顆粒層細胞退化的特異性調控(Fig. 3B-D)。GO富集分析的結果顯示Subcluster0顯著下調的差異基因(DEGs)主要富集于神經元形態異常和小腦形態異常等通路(Fig. 3E, F)。
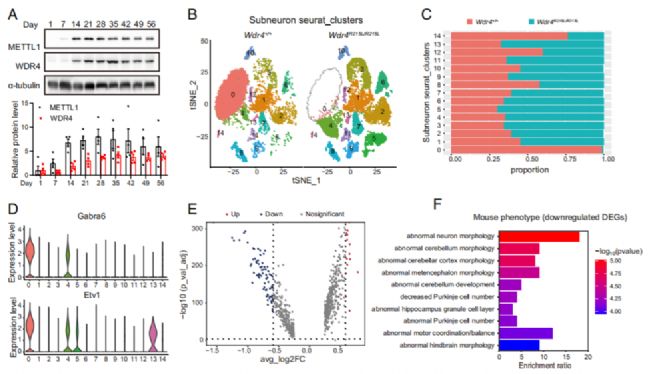
Fig. 3. Wdr4點突變小鼠腦部出現特定細胞類型隨時間退化
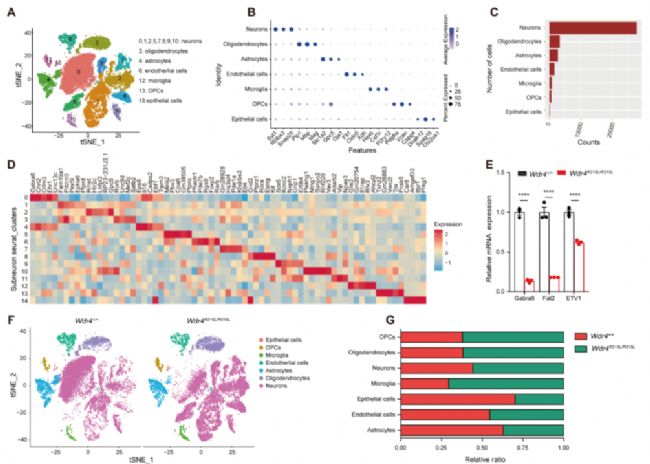
Fig. S2. 2月齡小鼠腦部snRNA-seq分析
4. Wdr4點突變抑制其自身與METTL1的互作并降低METTL1穩定性
以往的研究報道了METTL1/WDR4催化tRNA的m7G修飾這一機制,于是作者以此為基礎,進一步探究METTL1和WDR4在突變小鼠中的表達情況。腦部的METTL1在小腦中高表而在其他區域的表達量較低(與小腦萎縮表型相符),Wdr4的點突變顯著下調了tRNA的m7G水平和METTL1的蛋白水平,但是對后者的轉錄水平沒有顯著性的影響,而蛋白酶體抑制劑MG132的處理使得Wdr4突變的原代神經細胞中METTL1的蛋白水平顯著上調,暗示了Wdr4點突變導致了METTL1蛋白的降解(Fig. 4A-E)。
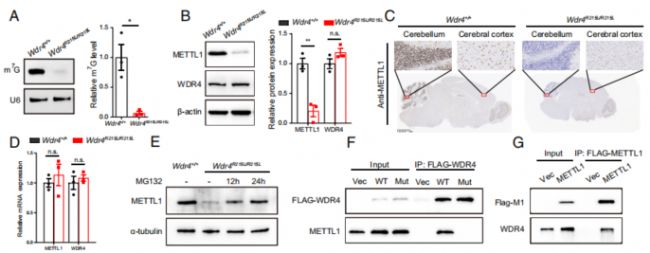
Fig. 4. Wdr4點突變通過蛋白降解降低METTL1穩定性
5. Wdr4點突變導致m7G tRNA修飾、mRNA翻譯下調及內質網應激上調
作者利用TRAC-seq進一步探究Wdr4點突變對神經退化的影響,篩選到了含有m7G修飾的tRNA基序“RRRGGT”,并發現了突變小鼠腦部tRNA m7G修飾水平的顯著下調,含m7G的tRNA水平下調但不含m7G的tRNA水平沒有顯著性變化(Fig. 5A-F)。嘌呤霉素實驗結果顯示,突變小鼠的嘌呤霉素攝入顯著降低,即翻譯水平顯著下調(Fig. 5G)。作者接著對野生型和突變小鼠的腦部進行了多聚核糖體測序(Polysome-seq),以探究小鼠腦部mRNA的翻譯效率,結果顯示,在突變小鼠腦部翻譯效率下調的基因帶有更多的m7G tRNA攜帶的密碼子,且TE的變化率與m7G 密碼子出現的頻率、數目以及編碼序列的長度顯著相關(Fig. 5H, I; Fig. S4A-C)。
TRAC-seq結果中,翻譯效率下調的基因主要富集在細胞應激、腦部發育和mTOR信號通路上,而RNA-seq的結果中又富集到了上調的細胞應激通路,即細胞應激相關基因在轉錄水平上的上調和翻譯水平上的下調(Fig. 5J-O)。此外Wdr4突變導致了內質網應激相關基因轉錄水平上的上調及該通路中關鍵分子IRE1和PERK的磷酸化水平上調,而降低PERK磷酸化水平則會同時使得促凋亡蛋白Bax和Bim的水平顯著下調(Fig. 5P, Q;Fig. S5)。另外,由于文獻報道過內質網應激與小膠質細胞激活之間的關聯,所以作者也對此進行了驗證,發現Ibal陽性的小膠質細胞在Day 35之后的突變小鼠小腦中快速擴張,與突變小鼠自Day 35開始出現小腦萎縮的表型一致(Fig. 5R)。
綜上,作者證明了小鼠腦部的Wdr4點突變會下調tRNA在相應位點的m7G修飾和mRNA翻譯,上調細胞應激和凋亡。
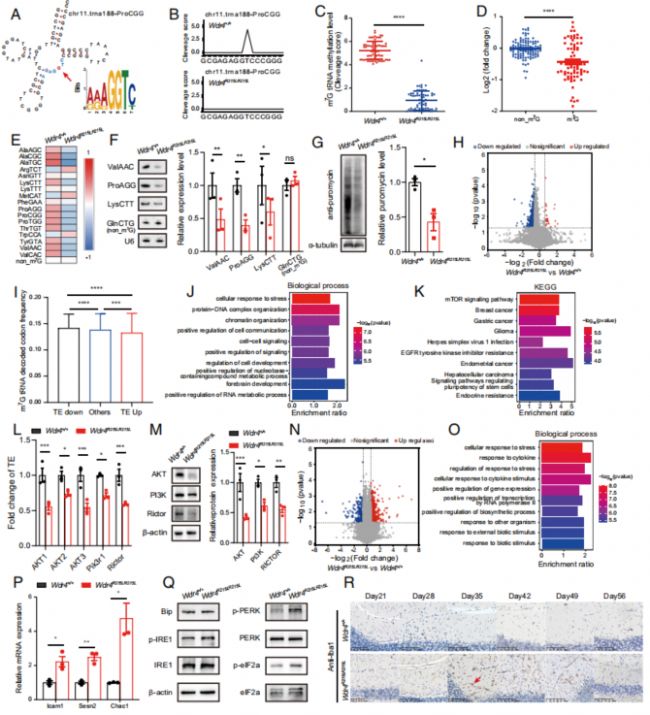
Fig. 5. Wdr4點突變引起tRNA m7G修飾下調,mRNA翻譯水平下調和內質網應激上調
6. 回補實驗及臨床應用前景
關于回補實驗的部分,作者循序漸進地設計了三種不同的回補實驗:
首先是利用FDA已經批準的可緩解細胞應激的藥物TUDCA對突變小鼠進行注射,注射治療后的突變小鼠在腦部形態和功能方面均有顯著的改善(Fig. S6)。
然而,盡管TUDCA的治療是有效的,但作者顯然不認為這是一種很理想的治療方式,因為這樣的治療方式需要患者每天都注射TUDCA。所以作者設計了通過AAV-PHPeB轉導野生型WDR4的來實現對突變小鼠進行治療的方法,AAV-PHPeB對小鼠腦部的感染效率很高,同時也的確使得突變小鼠在接受治療后,腦部的形態和相應功能得到了顯著的恢復(Fig. 6)。
最后,作者利用iPSC誘導獲得的人類神經元干細胞(NSCs)進行了體外實驗,分別進行了TUDCA處理和野生型WDR4轉導治療,以評估這兩種治療方式對人類患者臨床上常見位點突變WDR4的效果和潛在臨床應用價值。這兩種治療方式都可以顯著恢復WDR4突變的人類NSCs的增殖水平,并在分化的過程中緩解WDR4突變導致的凋亡(Fig. 7)。
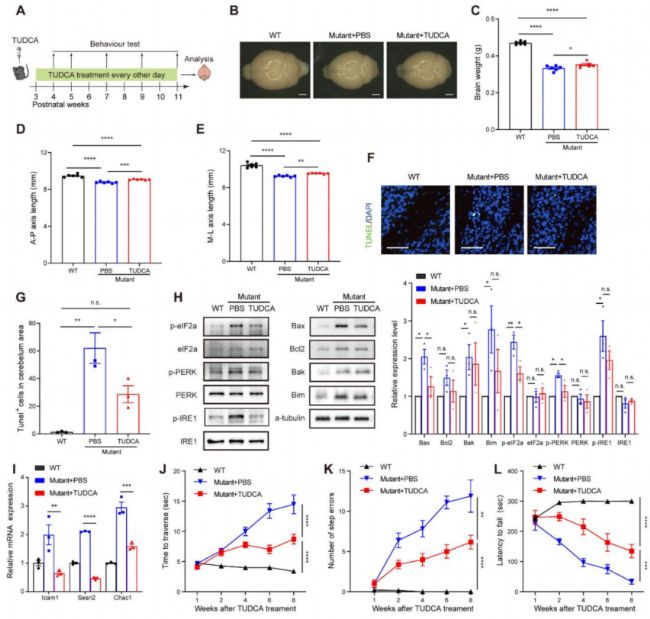
Fig. S6. TUDCA治療tRNA m7G修飾下調小鼠的腦功能
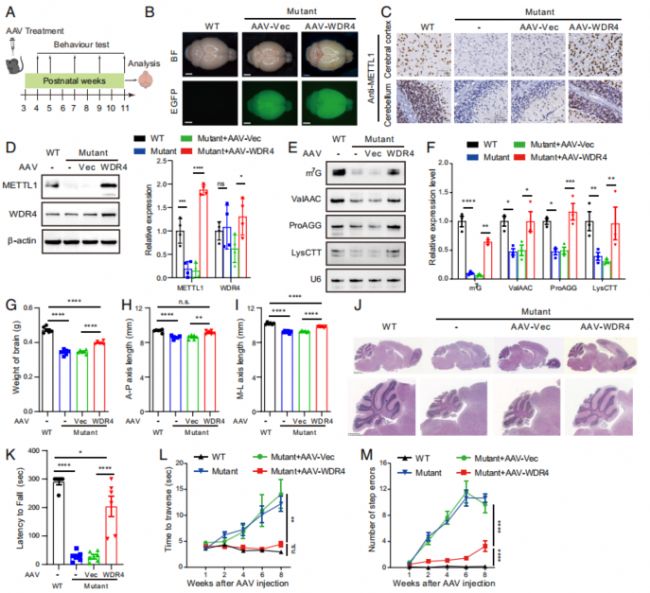
Fig. 6. tRNA修飾下調小鼠的長期治療干預
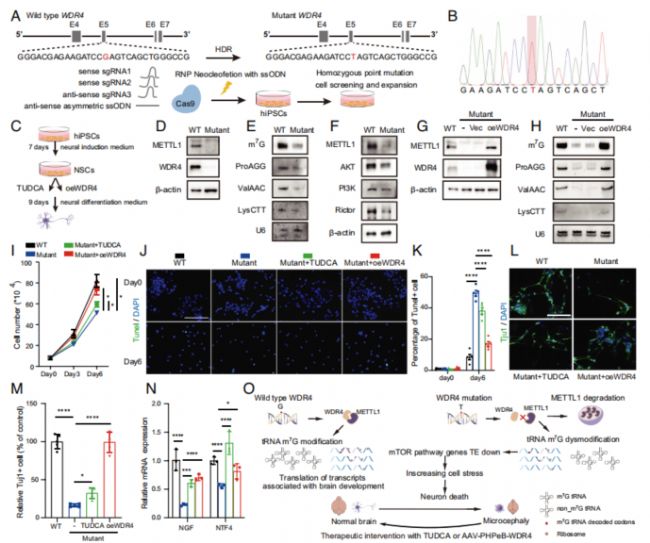
Fig. 7. TUDCA治療或回補野生型WDR4提升帶有WDR4突變的人類iPSC來源的NSC存活率和功能
研究總結
本文的完成度很高,作者的邏輯線非常清晰,從表型到機制再到回補都有詳細深入嚴謹的探究,所有的實驗設計和機制探索都緊緊圍繞著臨床上的表型展開,這也讓文章的結論具有更大的可能被實際應用在臨床治療中,不難看出作者背景知識和實驗設計方面的能力相當扎實。
本文中的snRNA-seq在本就完整連貫的故事鋪陳基礎上錦上添花,充分發揮了單細胞轉錄組學的最主要優勢,即精確區分細胞之間在轉錄水平上的細微差異,并通過這種差異準確地找到了一種具有顯著差異且與表型高度吻合的細胞亞型,作為本文故事主線的補充,也是向著另一個研究視角支線的初步探索。當然,本文的snRNA-seq數據中仍然有許多信息亟待挖掘和驗證,或許未來可以進一步地精準地探明WDR4對作者發現的特定細胞類型/亞型的調控機制,或者WDR4對其他細胞類型/亞型存在的潛在調控等等,這些研究是一個逐漸發展的過程,所以這些就要期待作者或后人未來的研究了。





