一、抗體與免疫球蛋白
抗體(antibody,Ab):是由抗原進入機體刺激B細胞分化增殖為漿細胞而合成并分泌的一類能與相應抗原發生特異性結合并產生免疫效應的含有糖基的球蛋白。抗體分布于體液(血液、淋巴液、組織液及粘膜的外分泌液)中,主要存在于血清內。

1964年世界衛生組織召開會議,將具有抗體活性及化學結構與抗體相似的球蛋白統稱為免疫球蛋白(immunoglobulin,Ig)。免疫球蛋白除分布于體液中之外,還可存在于B細胞膜上。
現代免疫學認為,抗體與免疫球蛋白是等同的概念;只是抗體側重于其生物學活性的描述,而免疫球蛋白側重強調其化學結構。
二、抗體的分類
1
免疫球蛋白可分為兩種類型:
(1) 分泌性免疫球蛋白:存在于血清、體液以及分泌液中,具有抗體的各種功能。
(2) 膜型免疫球蛋白:位于B淋巴細胞的表面,即膜表面免疫球蛋白(mIg),是B淋巴細胞的抗原識別受體(BCR)。
2
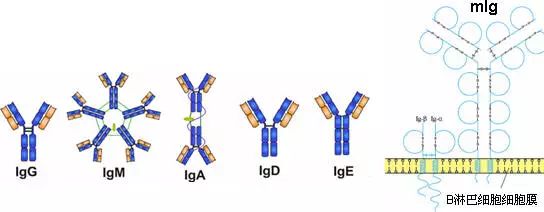
根據所對應的抗原分:

3
根據有無抗原刺激分:


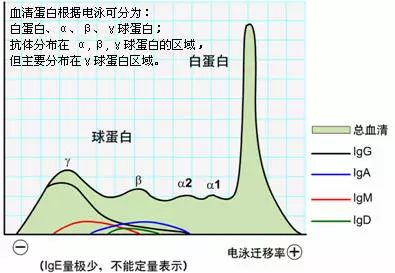
免疫球蛋白是多鏈糖蛋白,具有蛋白質的通性,對物理及化學因素敏感,不耐熱,在60~70℃時即被破壞,能被多種蛋白水解酶裂解破壞,可在乙醇、三氯醋酸或中性鹽類中沉淀。因此,通常用50%飽和硫酸銨或硫酸鈉從免疫血清中提取抗體。
抗體的結構
一、單體
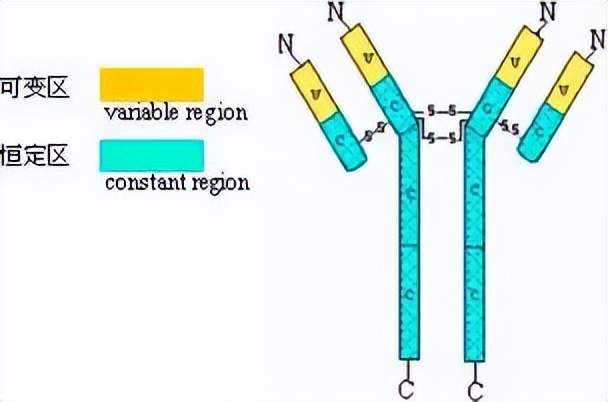
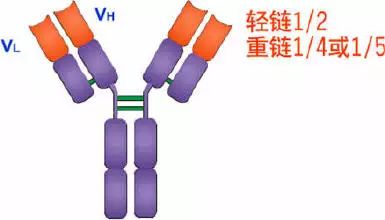
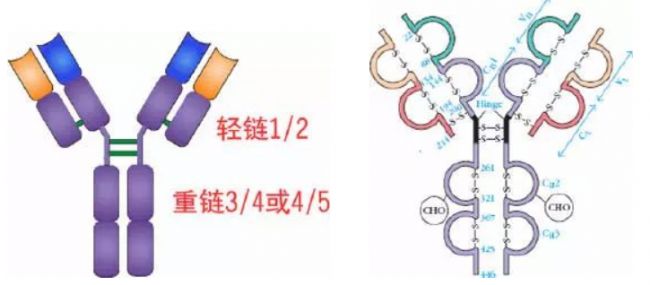
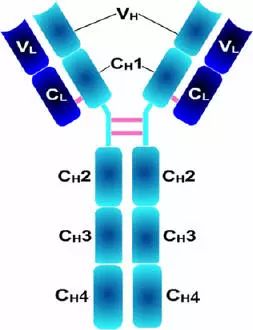
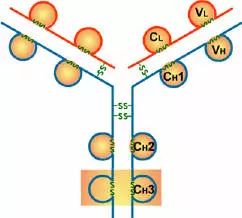
Porter等對血清IgG抗體的研究證明:Ig分子的基本結構是由四肽鏈組成的。即:由二條相同的分子量較小的肽鏈(輕鏈)和二條相同的分子量較大的肽鏈(重鏈)組成。
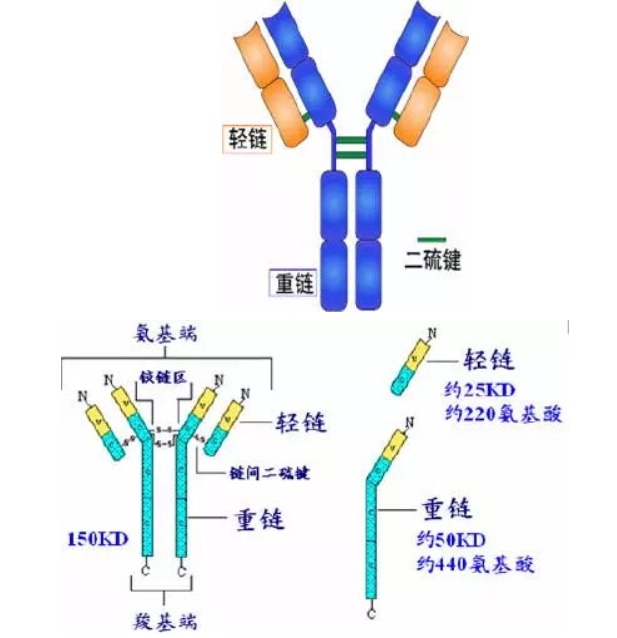
輕鏈與重鏈是由二硫鍵連接形成一個四肽鏈分子稱為Ig分子的單體;單體是構成所有免疫球蛋白分子的基本結構;所有抗體的單體都是四條肽鏈的對稱結構,即:兩條糖基化重鏈(H)和兩條非糖基化輕鏈(L);每條重鏈和輕鏈分為氨基端(N端)和羧基端(C端)。
二、輕鏈和重鏈
1、輕鏈(light chain,L鏈)
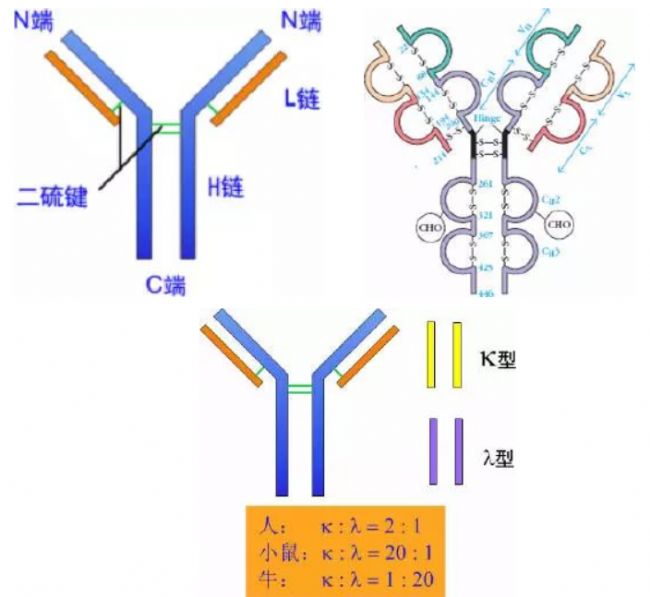
由214個氨基酸殘基組成,通常不含碳水化合物,分子量為24kD,有兩個由鏈內二硫鍵組成的環肽,L鏈可分為:Kappa(κ)與 lambda(λ)2個亞型。
2、重鏈(heavy chain,H鏈)
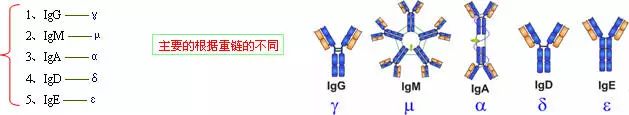
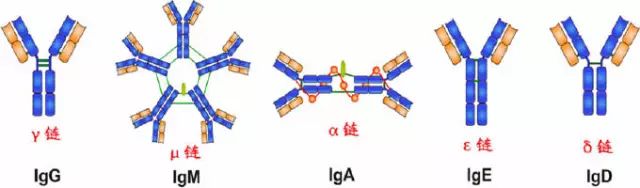
由450-550個氨基酸殘基組成,分子量55-75kD,含糖數量不同,4-5個鏈內二硫鍵,可分為5類,μ、γ、α、δ、ε鏈,不同的H鏈與L鏈(κ或λ)組成完整的Ig分子。分別稱為:IgM,IgG,IgA,IgD和IgE。
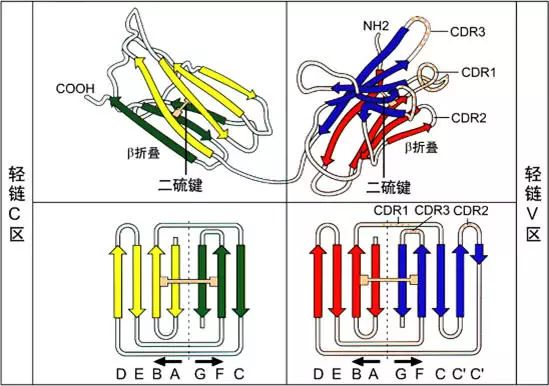
1、可變區(Variable region,V區)
L鏈N端1/2處(VL)108-111個氨基酸殘基,H鏈N端1/5-1/4處(VH)118個氨基酸殘基,V區有一個肽環65-75個氨基酸殘基。
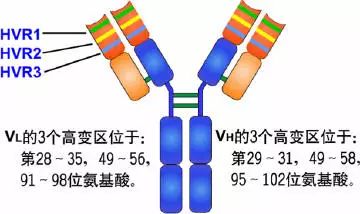
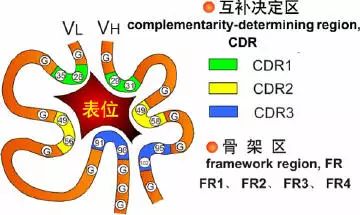
可變區可分為高變區(hypervariable region,HVR)和骨架區(framework region,FR),VL的HVR在24-34,50-56,89-97氨基酸位置。VH的HVR在31-35,50-56,95-102氨基酸位置。分別稱為VL和VH的HVR1,HVR2,HVR3。
高變區為抗體與抗原的結合位置,稱為決定簇互補區(
complementarity-determining region,CDR),VL和VH的HVR1,HVR2,HVR3又分別稱為CDR1,CDR2,CDR3,其中CDR3具有更高的高變程度,H鏈在與抗原結合中起重要的作用。
2、恒定區(constant region,C區)
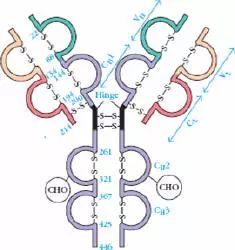
L鏈C端1/2處,105個氨基酸殘基,H鏈C端3/4-4/5處,331-431個氨基酸殘基。
在同一種屬動物中是比較恒定的,是制備第二抗體進行標記的重要基礎。
四、功能區
鏈內二硫鍵折疊成球形區稱為功能區(domain)約由110個氨基酸組成。氨基酸的順序具有高度的同源性。
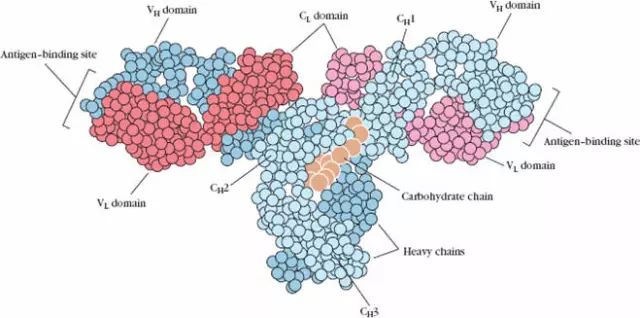
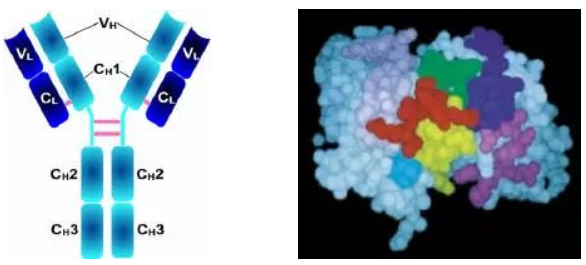
1、L鏈功能區:2個,(VL,CL各一個)
2、H鏈功能區:IgG,IgA,IgD,4個(V區1個,C區3個),IgM,IgE,5個(V區1個,C區4個)
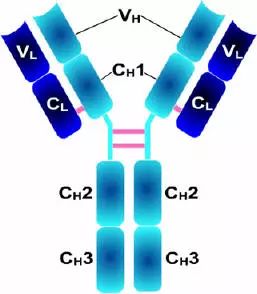
3、功能區的β片層結構:抗體的L鏈和H鏈中V區或C區每個功能區的二級結構是反向平行的β片層結構。
4、功能區的作用:
(1)VL和VH是抗原結合的部位。
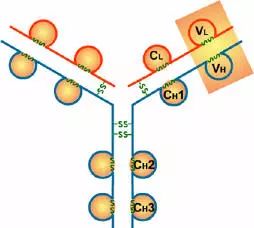
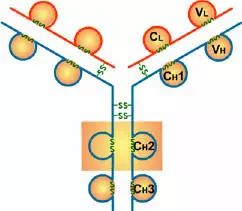
(2)CL和CH1上具有同種異型的遺傳標記。

(3)IgG的CH2和IgM的CH3具有補體C1q結合位點;IgG借助CH2部分可通過胎盤

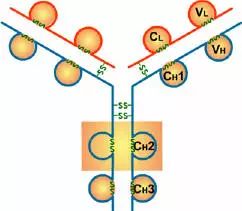
(4)CH3或CH4具有結合單核細胞、巨噬細胞、粒細胞、B細胞、NK細胞Fc段受體的功能,不同的抗體可與不同的細胞結合,產生不同的免疫效應。
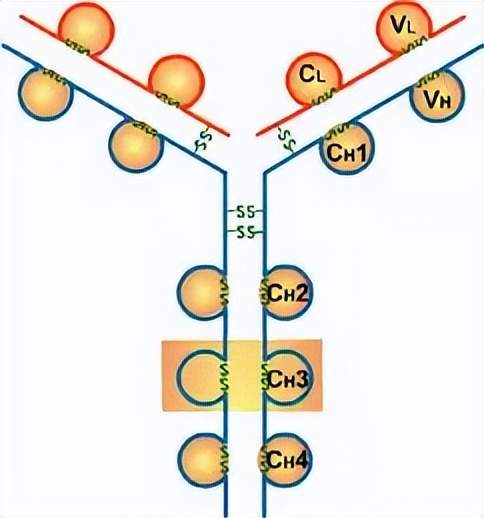
5、鉸鏈區
(1)鉸鏈區不是一個獨立的功能區,位于CH1與CH2之間;包括H鏈間二硫鍵,該區富含脯氨酸,不形成α-螺旋。
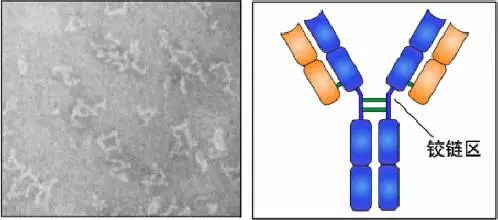
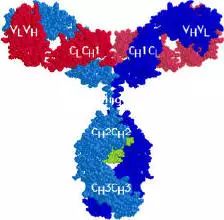
(2)當Ab與Ag結合時,鉸鏈區發生扭曲,使Ab的2個抗原結合點更好地與2個抗原決定簇互補。
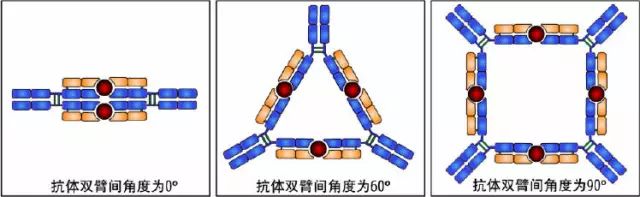
(3)由于CH2和CH3構型變化,顯示出活化補體、結合組織細胞等生物學活性。
(4)含有木瓜蛋白酶、胃蛋白酶的水解位點。
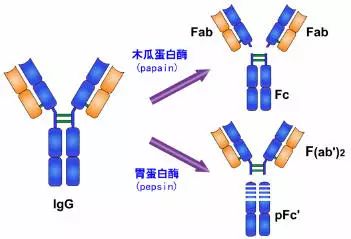
五、酶解片段
1.木瓜蛋白酶的水解片段
1959年 Porter用木瓜蛋白酶(papain)水解兔IgG分子,將IgG從絞鏈區二硫鍵的近N端側切斷,從而將免疫球蛋白裂解為三個片段,即2個相同的Fab段和1個Fc段。每一個Fab段即抗原結合片段(fragment antigen binding,Fab),含有一條完整的L鏈和H鏈近N 端側的1/2。每個Fab段結合抗原是單價的,即只能結合一個抗原決定簇。因此不能連結成較大的抗原抗體復合物,不出現凝集或沉淀現象。Fab中的約1/2 H鏈部分稱為Fd段,約含225個氨基酸殘基,包括VH、CH1和部分絞鏈區。Fc段在低溫或低離子強度下可形成結晶,故稱為可結晶片段(fragment crystallizable,Fc),Fc段含有兩條H鏈羧基端(C端)的一半,包含CH2和CH3兩個功能區,它無抗體活性。Ig在異種間免疫所具有的抗原性主要存在于Fc段,同時Fc段還具有活化補體、親細胞、通過胎盤和介導與細菌蛋白結合等生物學活性。
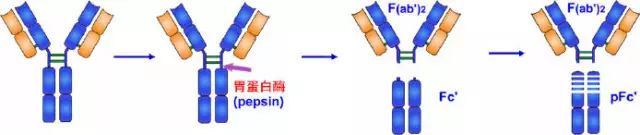
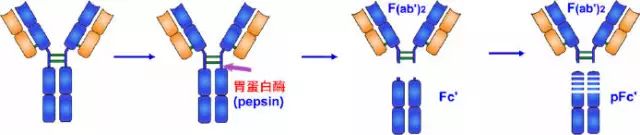
2、胃蛋白酶水解片段
1960年Nisonoff等最早用胃蛋白酶水解兔IgG分子,可將IgG從絞鏈區重鏈間二硫鍵近C端切斷,將其裂解為大小不等的兩個片段。大片段為1個Fab雙體,以F(ab')2表示。F(ab')2由一對L鏈和一對略大于Fd的H鏈(稱為Fd')組成。Fd'約含有235個氨基酸殘基,包括VH、CH1和絞鏈區。
F(ab')2結合抗原為雙價,可結合兩個抗原決定簇,其結合抗原的親合力要大于單價的Fab,與抗原結合后可出現凝集或沉淀現象。由于F(ab')2保持了結合相應抗原的生物學活性,又減少或避免了Fc段抗原性可能引起的副作用,因而在生物制品中有實際應用價值。雖然F(ab')2在與抗原結合特性方面同完整的Ig分子一樣,但由于缺乏Ig中的Fc部分,故不具備固定補體及與細胞膜表面Fc受體結合的功能。
小片段Fc可被胃蛋白酶繼續水解為小分子多肽,以Fc'表示,不再具有任何生物學活性。
六、J鏈和分泌成分
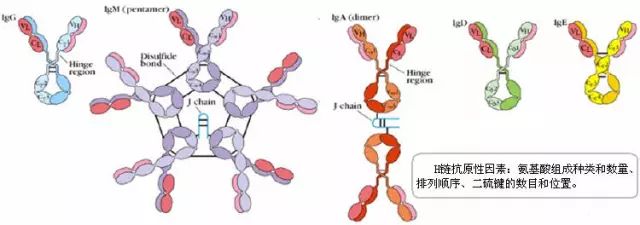
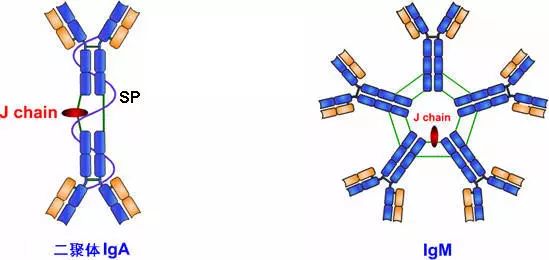
1、J鏈(joining chain)
(1)存在于二聚體IgA和五聚體IgM中;化學本質為酸性糖蛋白,分子量約15ku,含有8個半胱氨酸殘基。
(2)以二硫鍵連接到μ鏈或α鏈的羧基端的半胱氨酸,對抗體二聚體、五聚體的組成及在體內轉運具有一定的作用。
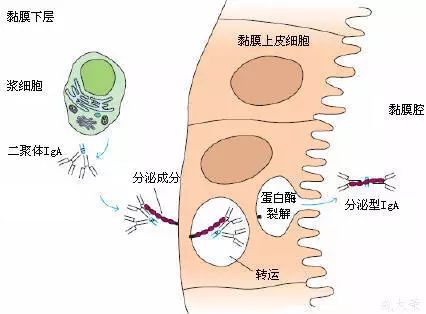
2、分泌成分(secretory component,SC)
(1)是二聚體IgA上的一個輔助成分;
(2)由上皮細胞合成,化學本質為糖蛋白,分子量約為75ku;
(3)以共價形式結合到IgA分子,并一起被分泌到粘膜表面,又稱分泌片(secretory piece, SP);
(4)可抵抗外分泌液中的蛋白水解酶對二聚體IgA的降解。
來源:E藥學苑
* 推文用于傳遞知識,如有版權等疑問,請聯系我們。