新型IRF1抑制劑作為潛在活性靶點減輕輻射誘導的細胞損傷的機制
由四川大學華西第二醫院放射醫學實驗室的Shuyu Zhang,Fenghao Geng,Xiaoqian Li 團隊發表的名為“Chaperone- and PTM-mediated activation of IRF1 tames radiation-induced cell death and the inflammatory response”的論文中,研究人員從ChemBridge化合物庫中篩選出能夠與IRF1的DNA結合域(DBD)結合的小分子,從而抑制其轉錄活性,能夠減輕輻射誘導的細胞損傷。AbMole是ChemBridge在中國的官方指定合作伙伴。

IRF1具有轉錄因子、介導炎癥反應、影響細胞命運、與免疫細胞的相互作用等功能,在調節細胞死亡和組織修復平衡中有重要作用。IRF1在放射損傷中的作用具有雙重性,既有助于細胞應對損傷和組織修復,也可能在一定程度上加重損傷和引發慢性炎癥反應。因此,研究IRF1在放射損傷中的具體作用機制,對于開發針對放射性損傷的治療策略具有重要意義。
研究人員通過蛋白質組學等一系列實驗,發現了IRF1通過調節線粒體氧化代謝、細胞膜相關蛋白、免疫炎癥、細胞增殖和分化、轉錄調節和細胞衰老死亡等多個方面的關鍵基因,調節細胞的損傷和修復平衡。尤其是IRF1的DBD結構域可以與Caspase1等凋亡相關基因的啟動子結合,從而導致細胞凋亡損傷。抑制IRF1能有效地保護細胞免受輻射損傷。
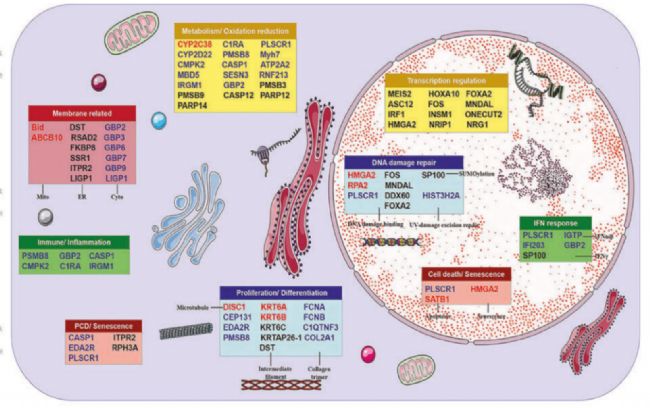 圖1:IRF1作用的靶基因示意。
圖1:IRF1作用的靶基因示意。
確認IRF1的保護作用后,研究者們從ZINC綜合數據庫中下載了210,000個化合物的結構信息。通過對這些化合物氫鍵、疏水性等理化性質進行初篩,研究者們在這些化合物中,篩選出50,000個化合物進行進一步的分子對接分析,評估化合物與IRF1主要發揮作用的DBD結構域的相互作用,得到25個評分較高的化合物。 圖2:靶點蛋白-化合物分子對接示意圖
圖2:靶點蛋白-化合物分子對接示意圖
之后,研究者對這25個化合物進行了熒光素酶報告基因實驗和染色質免疫共沉淀(CHIP)實驗。結果顯示,化合物I-2 和I-19(這2個化合物均來自ChemBridge)能顯著抑制IRF1與Caspase-1的啟動子區域的結合,從而減少Caspase-1的轉錄和細胞凋亡。
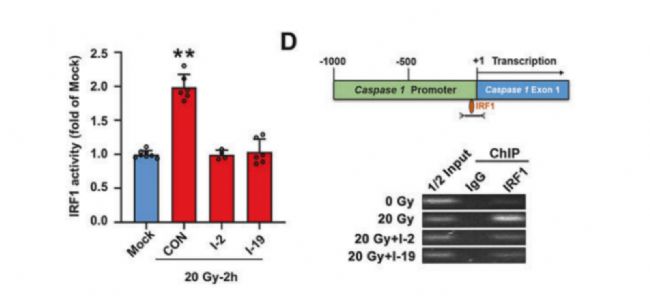 圖3:I-2和I-9顯著抑制IRF1結合Caspase-1的啟動子
圖3:I-2和I-9顯著抑制IRF1結合Caspase-1的啟動子
通過克隆形成和流式細胞凋亡實驗顯示,ChemBridge的化合物I-2 和I-19能夠顯著增加人皮膚細胞HaCat在輻射條件下的克隆形成,并減少在輻射條件下HaCat細胞的凋亡,顯示出強大的抗輻射損傷能力。其損傷修復和保護效果顯著。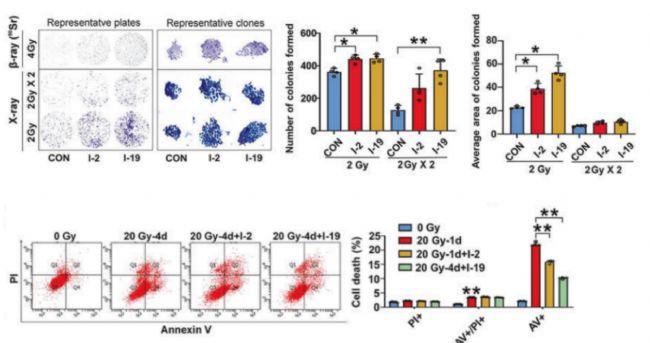 圖4:I-2 和I-19保護了輻射條件下的細胞
圖4:I-2 和I-19保護了輻射條件下的細胞
最后,研究者通過小鼠前爪輻射損傷模型評估了ChemBridge的化合物I-2 和I-19的作用。結果顯示,在體內I-2 和I-19也能顯著發揮損傷修復和保護作用,減輕了小鼠前爪受到的輻射損傷。I-2 和I-19在體內外均顯示出不錯的效果。 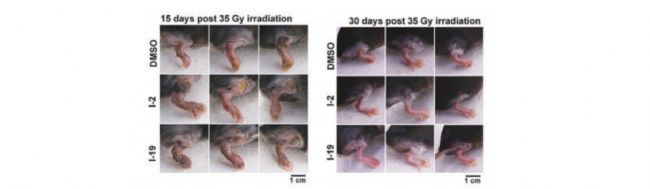 圖5:I-2 和I-19在輻射中保護了小鼠
圖5:I-2 和I-19在輻射中保護了小鼠
在本研究中,研究者通過蛋白質組學等手段,確認了IRF1蛋白是保護輻射損傷的潛在活性靶點。之后通過虛擬篩選與生物實驗的結合運用,篩選獲得了在體內外均有出色輻射保護效果的新型IRF1抑制劑— I-2 和I-19。在此過程中,ChemBridge的高命中率化合物為最終取得突破成果提供了有力的支持。從210000個化合物開始,到50000個,再25個,最終ChemBridge的2個化合物從各品牌的化合物中脫穎而出!

AbMole是ChemBridge在中國的官方指定合作伙伴。
鳴謝:Shuyu Zhang, Fenghao Geng, Xiaoqian Li, et al. Cell Mol Immunol. 2024 Aug;21(8):856-872.

IRF1具有轉錄因子、介導炎癥反應、影響細胞命運、與免疫細胞的相互作用等功能,在調節細胞死亡和組織修復平衡中有重要作用。IRF1在放射損傷中的作用具有雙重性,既有助于細胞應對損傷和組織修復,也可能在一定程度上加重損傷和引發慢性炎癥反應。因此,研究IRF1在放射損傷中的具體作用機制,對于開發針對放射性損傷的治療策略具有重要意義。
研究人員通過蛋白質組學等一系列實驗,發現了IRF1通過調節線粒體氧化代謝、細胞膜相關蛋白、免疫炎癥、細胞增殖和分化、轉錄調節和細胞衰老死亡等多個方面的關鍵基因,調節細胞的損傷和修復平衡。尤其是IRF1的DBD結構域可以與Caspase1等凋亡相關基因的啟動子結合,從而導致細胞凋亡損傷。抑制IRF1能有效地保護細胞免受輻射損傷。
 圖1:IRF1作用的靶基因示意。
圖1:IRF1作用的靶基因示意。確認IRF1的保護作用后,研究者們從ZINC綜合數據庫中下載了210,000個化合物的結構信息。通過對這些化合物氫鍵、疏水性等理化性質進行初篩,研究者們在這些化合物中,篩選出50,000個化合物進行進一步的分子對接分析,評估化合物與IRF1主要發揮作用的DBD結構域的相互作用,得到25個評分較高的化合物。
 圖2:靶點蛋白-化合物分子對接示意圖
圖2:靶點蛋白-化合物分子對接示意圖之后,研究者對這25個化合物進行了熒光素酶報告基因實驗和染色質免疫共沉淀(CHIP)實驗。結果顯示,化合物I-2 和I-19(這2個化合物均來自ChemBridge)能顯著抑制IRF1與Caspase-1的啟動子區域的結合,從而減少Caspase-1的轉錄和細胞凋亡。
 圖3:I-2和I-9顯著抑制IRF1結合Caspase-1的啟動子
圖3:I-2和I-9顯著抑制IRF1結合Caspase-1的啟動子通過克隆形成和流式細胞凋亡實驗顯示,ChemBridge的化合物I-2 和I-19能夠顯著增加人皮膚細胞HaCat在輻射條件下的克隆形成,并減少在輻射條件下HaCat細胞的凋亡,顯示出強大的抗輻射損傷能力。其損傷修復和保護效果顯著。
 圖4:I-2 和I-19保護了輻射條件下的細胞
圖4:I-2 和I-19保護了輻射條件下的細胞最后,研究者通過小鼠前爪輻射損傷模型評估了ChemBridge的化合物I-2 和I-19的作用。結果顯示,在體內I-2 和I-19也能顯著發揮損傷修復和保護作用,減輕了小鼠前爪受到的輻射損傷。I-2 和I-19在體內外均顯示出不錯的效果。
 圖5:I-2 和I-19在輻射中保護了小鼠
圖5:I-2 和I-19在輻射中保護了小鼠在本研究中,研究者通過蛋白質組學等手段,確認了IRF1蛋白是保護輻射損傷的潛在活性靶點。之后通過虛擬篩選與生物實驗的結合運用,篩選獲得了在體內外均有出色輻射保護效果的新型IRF1抑制劑— I-2 和I-19。在此過程中,ChemBridge的高命中率化合物為最終取得突破成果提供了有力的支持。從210000個化合物開始,到50000個,再25個,最終ChemBridge的2個化合物從各品牌的化合物中脫穎而出!

AbMole是ChemBridge在中國的官方指定合作伙伴。
鳴謝:Shuyu Zhang, Fenghao Geng, Xiaoqian Li, et al. Cell Mol Immunol. 2024 Aug;21(8):856-872.
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





