可溫和條件下高分辨率檢測m6A修飾的新m6A測序方法開發研究
RNA和DNA中的化學修飾在多種生物過程中發揮著關鍵作用,包括轉錄調控、RNA降解、蛋白質翻譯和免疫調節等。這些修飾已被新的測序方法以單堿基分辨率定量地繪制出來,其中核苷酸脫氨基是一種高效策略,用于選擇性地繪制DNA中的5-甲基胞嘧啶(5-methylcytosine)和RNA中的N6-甲基腺苷(m6A)。然而,傳統的化學脫氨基方法依賴于在苛刻的酸性條件下使用芳基重氮鹽,這限制了其在大多數生物底物中的應用。近年來,基于亞硝酸鹽離子的RNA測序方法(如NO-seq和NT-seq)雖然簡單且成本效益高,但低轉化效率和苛刻的酸處理可能會導致RNA降解,從而影響檢測的準確性。此外,GLORI方法雖然提高了脫氨基效率和選擇性,但仍受到RNA降解和逆轉錄停止的限制,需要大量的RNA輸入。
為了開發一種溫和的化學脫氨基反應,以克服傳統方法的局限性。近日,芝加哥大學何川團隊通過設計一種接近中性pH值的溫和化學脫氨基反應,不僅可以顯著保護RNA,還能提高信噪比,從而實現對m6A位點的靈敏且穩健繪制。這種方法有望為研究m6A修飾在基因表達調控中的作用提供有力的工具,推動RNA修飾領域的研究進展。相關成果以《Small-molecule-catalysed deamination enables transcriptome-wide profiling of N6-methyladenosine in RNA》為題,發表于Nature子刊《Nature Chemistry》。

標題:Small-molecule-catalysed deamination enables transcriptome-wide profiling of N6-methyladenosine in RNA
發表時間:2025-4-17
發表期刊:Nature Chemistry
影響因子:IF19.2/Q1
單位:芝加哥大學
研究方法
研究者采用一種N-亞硝化策略,通過羰基有機催化劑和路易斯酸催化劑的協同催化作用,實現對RNA中腺苷(A)的脫氨基反應,將其轉化為次黃嘌呤(I)。這種方法被稱為化學協同催化輔助m6A測序(chemical cooperative catalysis-assisted m6A sequencing,CAM-seq)。具體實驗步驟如下: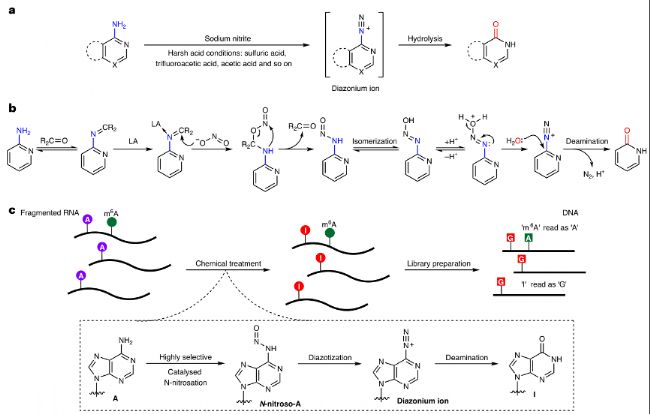
圖1:羰基有機催化劑和路易斯酸催化的一級胺協同脫氨基反應。
a. 在苛刻的酸性條件下,亞硝酸鹽離子通過逐步的亞硝化和重氮化反應介導脫氨基作用。
b. 本研究和GLORI-seq:由羰基有機催化劑和路易斯酸(LA)催化的協同脫氨基反應。
c. 全轉錄組m6A測序的m6A-CAM-seq方法示意圖。RNA樣本被片段化,并在優化的條件下進行處理,隨后進行純化和測序文庫制備。
研究結果
(1)溫和條件下對底物進行一般脫氨基處理
研究者在溫和條件下對多種核苷酸底物進行了脫氨基反應,發現甘油醛與硼酸三氟化物乙醚(BF3·OEt2)組合能高效脫氨基廣泛的核苷酸底物。通過改變羰基催化劑,從二羰基有機催化劑改為單羰基有機催化劑(如糠醛),可以顯著提高鳥苷類似物的脫氨基產率。研究者推測這可能是因為鳥苷類似物在位置6處可以與甘油醛環化,形成鳥苷-甘油醛加合物。
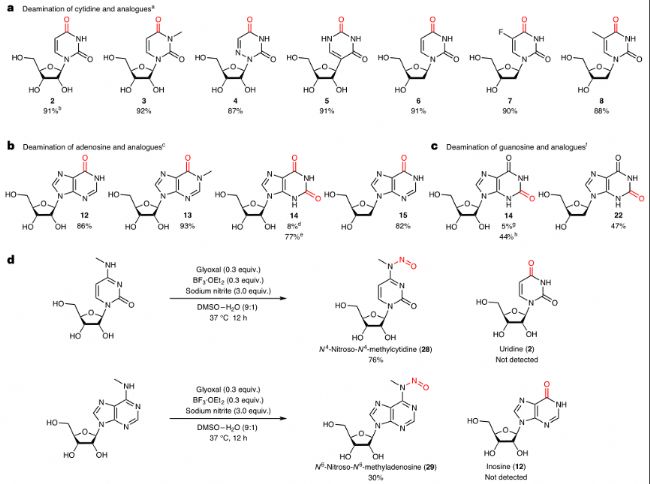
d. 在優化的催化條件下,對甲基化核苷進行反應。
(2)闡明反應機制
通過15N核磁共振(NMR)光譜學跟蹤反應過程,研究者發現,在沒有路易斯酸的情況下,15N6腺苷與甘油醛的縮合反應非常緩慢,即使在50℃下加熱2小時后,縮合產物的形成仍然很少。然而,加入BF3·OEt2后,15N標記的腺苷在半小時內迅速轉化為中間體Int 3。二維1H-15N HMBC光譜學被用來監測路易斯酸催化的縮合反應,具有更高的15N靈敏度。在Na15NO2存在的情況下,15N亞胺信號消失,表明其轉化為脂肪族硝基取代的中間體,并隨后重排為N-亞硝化加合物。這些結果證實了通過亞胺中間體的反應路徑。
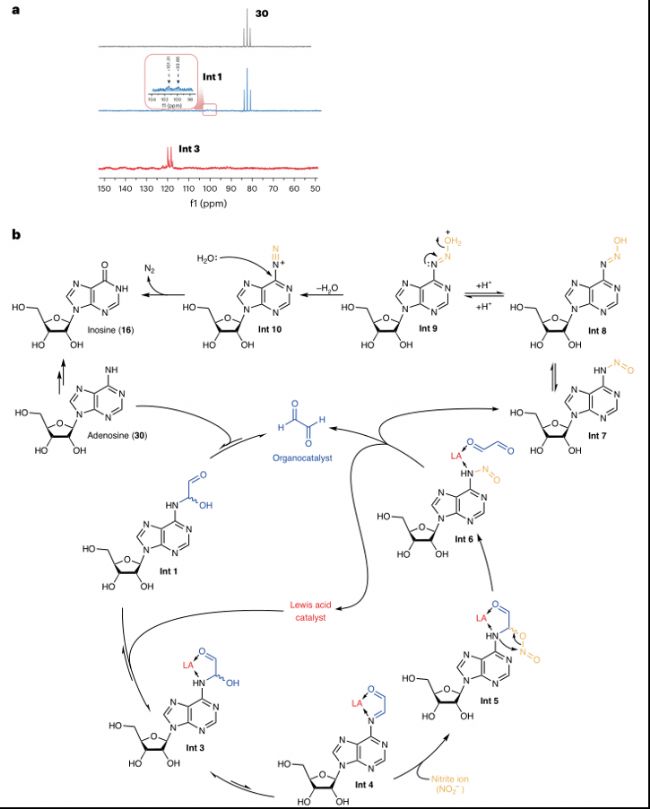
b. 提出的脫氨基反應的催化循環。
(3)DNA和RNA中腺苷脫氨基的選擇性條件
研究者進一步探索了優化CAM-seq選擇性條件,使其對腺苷的脫氨基反應具有更高的選擇性。通過測試不同的路易斯酸,發現硼酸在提高反應活性方面最為有效。在硼酸存在的情況下,二羰基化合物比單羰基化合物具有更高的脫氨基效率。通過液相色譜-串聯質譜(LC-MS/MS)分析,甘油醛和三氟丙醛都表現出對腺苷的選擇性,但由于三氟丙醛導致的顯著DNA/RNA降解,研究者選擇了甘油醛進行進一步研究。在優化的脫氨基條件下,甘油醛在DNA和RNA中都表現出對腺苷的完全脫氨基反應,而m6A位點保持不變。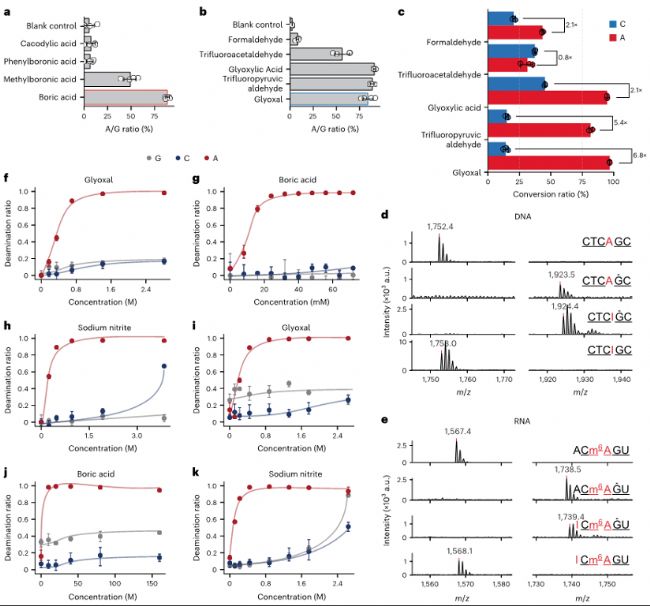
c.不同羰基有機催化劑對A和C脫氨基的催化效率比較。二羰基催化劑在A位點的轉化率高于C位點。
d.在優化條件下,6堿基DNA寡核苷酸CTCAGC表現出對G保護和A脫氨基的高反應性。
e.使用5堿基m6A RNA寡核苷酸探針(ACm6AGU),在與d相似條件下展示A和m6A的選擇性。
f-h. LC–MS/MS監測DNA寡核苷酸脫氨基反應中甘油醛(f)、硼酸(g)和亞硝酸鹽(h)濃度的優化(n=3)。
i-k. LC–MS/MS監測RNA寡核苷酸脫氨基反應中甘油醛(i)、硼酸(j)和亞硝酸鹽(k)濃度的優化(n=3)。
(4)CAM-seq m6A檢測的優化條件
研究者注意到,盡管甘油醛作為一種有機催化劑非常有效,但它傾向于與鳥苷形成加合物,這可能導致逆轉錄酶在逆轉錄過程中停止(RT stops)。因此,研究者選擇了kethoxal作為保護基團,因為它具有更高的反應速率和更好的可逆性。在優化條件下,CAM-seq能夠在接近中性的pH值下進行,顯著減少RNA降解。通過測試11種不同的逆轉錄酶和3種不同的dNTP比例(dTTP/dCTP比例為1:1、1:40和1:400),研究者發現RevertAid RT在dTTP/dCTP比例為1:40時,背景噪聲水平最低,約為0.36%。

b. 使用kethoxal保護的RNA寡核苷酸探針在與a相似的條件下展示了RT停止比率。
c-f. 在中性條件下,使用甘油醛(c,d)和kethoxal(e,f)對DNA寡核苷酸的籠化(caging)(c,e)和去籠化(decaging)(d,f)動態比較。
g. 在中性條件下,甘油醛對kethoxal完全籠化的DNA寡核苷酸的競爭。
h-i. 使用完整的RNA(h)和200個核苷酸片段化的RNA(i)進行RNA降解實驗。
j. 通過插入寡核苷酸測序數據優化逆轉錄酶條件。測試了11種逆轉錄酶和3種dTTP/dCTP比例(1:1、1:40和1:400)。一個突出的條件(RevertAid RT在1:40比例下)顯示出低于0.36%的背景噪聲水平。
(5)人、擬南芥、玉米等不同物種轉錄組中的m6A全面圖譜
使用優化的CAM-seq協議,研究者在人類HEK293T細胞系中鑒定了282281個高度可信的m6A位點(P<0.001)。其中,235173個和180056個位點的修飾比例分別大于5%和10%。GAC motif最為富集,占HEK293T轉錄組中可信位點的54%,其次是AAC motif,占27%。值得注意的是,YAC(CAC/UAC)和RAU(GAU/AAU)motif,這些與RAC motif僅相差一個核苷酸的motif,也顯示出一定程度的m6A修飾。在人類轉錄組中,m6A富集的motif(如GAC)在3'-UTR區域的終止密碼子附近表現出明顯的富集信號,進一步證實了CAM-seq能夠提供整個轉錄組的高質量m6A圖譜。
研究者還對擬南芥和玉米的RNA樣本進行了分析,發現RAC motif在這些植物中也是最富集的m6A修飾motif。然而,與人類樣本不同的是,RAC motif僅占植物中所有m6A位點的40%,而在人類樣本中約為85%。此外,植物中AAC motif豐度最高,而在人類中則是GAC motif豐度最高。這些結果表明,植物中的m6A修飾模式與人類存在差異,可能與植物中m6A修飾的調控機制有關。
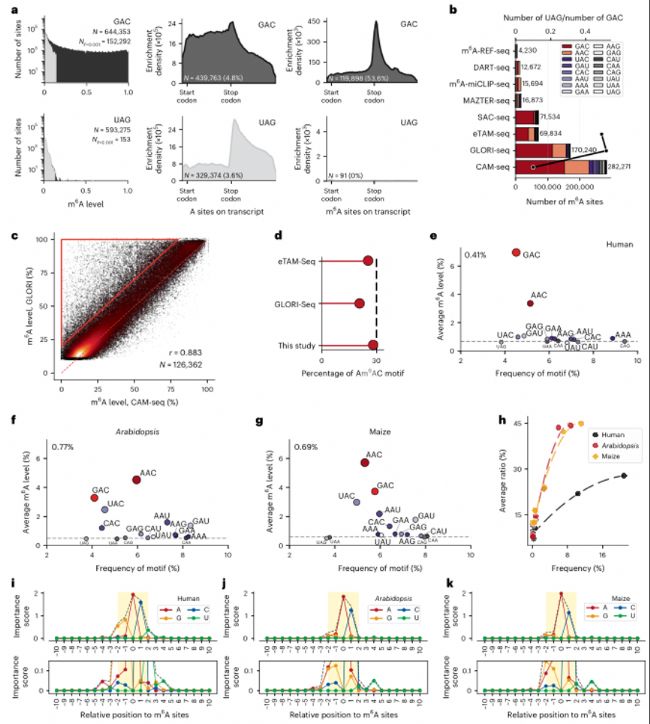
b. 多種方法檢測到的m6A位點與估計背景噪聲的比較。
c. CAM-seq和GLORI-seq在126362個重疊位點上m6A水平的相關性(r=0.883)。紅色虛線表示相等水平。紅色三角形標記的區域突出了GLORI-seq高估m6A水平的位點。
d. 在三種基于脫氨基的方法中觀察到的所有m6A位點中,AAC motif的比例,計算為所有位點的(m6A比率×覆蓋率)之和與所有位點的(m6A比率×覆蓋率)之和的比值。
e. 人類樣本中所有A位點(無過濾)的平均甲基化水平與相對motif頻率的關系。GAC和AAC motif(紅色)高于背景水平。整體m6A水平表示為0.41%。
f-g. 擬南芥(f)和玉米(g)中所有A位點的平均甲基化水平與相對motif頻率的關系。整體m6A水平分別表示為0.77%和0.69%。
h. 人類、擬南芥和玉米中通過過濾的16 three-letter motif的頻率與平均甲基化水平之間的關系。
i-k. 人(i)、擬南芥(j)和玉米(k)中相對于m6A位點的每個位置核苷酸重要性評分。
(6)飽和分析將轉錄速率與m6A水平關聯分析
研究者通過飽和m6A圖譜分析發現,基因表達水平與平均m6A水平呈負相關。具體來說,高轉錄率基因傾向于具有較低m6A水平,可能是由于m6A沉積復合物的可用性有限,或者甲基轉移酶復合物與轉錄機制在細胞內的動態關聯。此外,研究者還發現,基因的最大m6A修飾水平可以作為區分基因的一個重要參數。將基因分為兩組:一組是所有m6A位點的修飾水平普遍較低的基因,另一組是具有高修飾潛力的基因。這兩組基因的表達水平與m6A水平都呈現出顯著的負相關性。
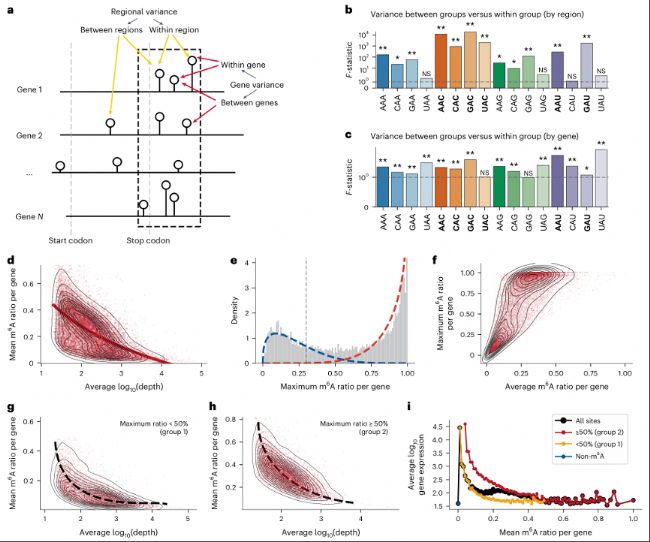
b. 基于meta基因分析,終止密碼子附近的-20到+180核苷酸區域被確定為m6A沉積的熱點區域。
c. 基因間和單個基因內的變異對應數據。
d. log10基因表達水平與平均m6A水平之間的關系,以等高線圖表示,并帶有虛線趨勢線。
e. 所有基因的最大m6A修飾水平分布。低甲基化和高甲基化組的擬合曲線分別用藍色和紅色虛線標記。
f. 基因內平均m6A修飾水平與最大m6A修飾水平之間的相關性。
g-h. 僅低修飾基因(g)和僅高修飾基因(h)的log10基因表達水平與平均m6A水平之間的關系。
i. 所有基因(黑色)、無m6A修飾基因(藍色)、低m6A修飾基因(黃色)和高m6A修飾基因(紅色)的m6A水平與基因表達之間的總體關系。
CAM-seq、NO-seq、NT-seq、GLORI、MeRIP-seq等m6A測序方法介紹及比較
(1)CAM-seq(化學協同催化輔助的m6A測序)
原理:通過化學協同催化策略,利用羰基催化劑和路易斯酸催化劑的協同作用,將RNA中的腺苷(A)轉化為次黃嘌呤(I),而m6A位點抵抗脫氨基反應,保持為腺苷。通過逆轉錄酶或DNA聚合酶讀取時,I被讀作鳥嘌呤(G),從而實現m6A檢測。
優點:
溫和條件:反應在接近中性的pH值下進行,避免了RNA降解。
低背景噪聲:背景噪聲低至0.5%,遠低于其他方法。
低輸入量:僅需10ng的RNA輸入即可實現高分辨率檢測。
高靈敏度:能夠檢測到低比例的m6A修飾位點。
應用場景:
適用于低輸入量的RNA樣本,如單細胞RNA測序、微量組織樣本等。
(2)NO-seq(硝酸鹽介導的m6A測序)
原理:通過硝酸鹽離子介導的化學脫氨基反應,將RNA中的腺苷(A)轉化為次黃嘌呤(I),從而實現m6A的檢測。
優點:
操作簡單:不需要復雜的酶反應步驟。
成本低:試劑成本較低。
缺點:
反應條件苛刻:需要在酸性條件下進行,可能導致RNA降解。
背景噪聲高:由于反應不完全,背景噪聲較高,影響檢測準確性。
(3)NT-seq(硝酸鹽介導的轉錄組測序)
原理:與NO-seq類似,通過硝酸鹽離子介導的化學脫氨基反應,將RNA中的腺苷(A)轉化為次黃嘌呤(I),從而實現m6A的檢測。
優點:
操作簡單:不需要復雜的酶反應步驟。
成本低:試劑成本較低。
缺點:
反應條件苛刻:需要在酸性條件下進行,可能導致RNA降解。
背景噪聲高:由于反應不完全,背景噪聲較高,影響檢測準確性。
(4)GLORI(化學保護基團介導的m6A測序)
原理:通過化學保護基團(如甘油醛)保護鳥苷(G),然后進行化學脫氨基反應,將RNA中的腺苷(A)轉化為次黃嘌呤(I),從而實現m6A的檢測。
優點:
選擇性高:通過保護基團的選擇性保護,提高了脫氨基反應的選擇性。
高靈敏度:能夠檢測到低比例的m6A修飾位點。
缺點:
反應條件苛刻:需要在酸性條件下進行,可能導致RNA降解。
背景噪聲高:由于保護基團的不完全去除,可能導致背景噪聲較高。
高輸入量:需要較多的RNA輸入量(通常為微克級別)。
(5)MeRIP-seq(m6A免疫沉淀測序)
原理:通過特異性的m6A抗體對RNA進行免疫沉淀,然后通過高通量測序檢測m6A修飾位點。
優點:
全轉錄組:能夠實現全轉錄組的m6A檢測。
廣泛適用:適用于多種類型的RNA樣本。
缺點:
高輸入量:需要較多的RNA輸入量(通常為微克級別)。
背景噪聲高:由于抗體的非特異性結合,可能導致背景噪聲較高。
操作復雜:需要進行免疫沉淀步驟,操作較為復雜。
參考文獻:
Wang, P., Ye, C., Zhao, M. et al. Small-molecule-catalysed deamination enables transcriptome-wide profiling of N6-methyladenosine in RNA. Nat. Chem. (2025). https://doi.org/10.1038/s41557-025-01801-3
為了開發一種溫和的化學脫氨基反應,以克服傳統方法的局限性。近日,芝加哥大學何川團隊通過設計一種接近中性pH值的溫和化學脫氨基反應,不僅可以顯著保護RNA,還能提高信噪比,從而實現對m6A位點的靈敏且穩健繪制。這種方法有望為研究m6A修飾在基因表達調控中的作用提供有力的工具,推動RNA修飾領域的研究進展。相關成果以《Small-molecule-catalysed deamination enables transcriptome-wide profiling of N6-methyladenosine in RNA》為題,發表于Nature子刊《Nature Chemistry》。

發表時間:2025-4-17
發表期刊:Nature Chemistry
影響因子:IF19.2/Q1
單位:芝加哥大學
研究方法
研究者采用一種N-亞硝化策略,通過羰基有機催化劑和路易斯酸催化劑的協同催化作用,實現對RNA中腺苷(A)的脫氨基反應,將其轉化為次黃嘌呤(I)。這種方法被稱為化學協同催化輔助m6A測序(chemical cooperative catalysis-assisted m6A sequencing,CAM-seq)。具體實驗步驟如下:
- 反應條件優化:通過篩選不同的路易斯酸和羰基化合物,研究者發現硼酸和甘油醛(glyoxal)在促進脫氨基反應中表現出最高的效率和選擇性。反應在接近中性的pH值(pH 6.0)下進行,溫度為37℃,時間為12小時。
- 保護基團的選擇:為了避免甘油醛與鳥苷(G)形成加合物導致的逆轉錄酶停止(RT stops),研究者選擇了kethoxal作為保護基團,因為它具有更高的反應速率和更好的可逆性。
- RNA樣本處理:從細胞或植物組織中提取總RNA,并進行poly(A)富集。將提取的RNA片段化,以提高測序效率。
- 測序文庫制備:對化學處理后的RNA進行3'-端修復,連接3'-端接頭,進行逆轉錄反應生成cDNA,再連接cDNA接頭,完成文庫制備。最后對文庫進行PCR擴增,并使用Illumina平臺進行測序。

圖1:羰基有機催化劑和路易斯酸催化的一級胺協同脫氨基反應。
b. 本研究和GLORI-seq:由羰基有機催化劑和路易斯酸(LA)催化的協同脫氨基反應。
c. 全轉錄組m6A測序的m6A-CAM-seq方法示意圖。RNA樣本被片段化,并在優化的條件下進行處理,隨后進行純化和測序文庫制備。
研究結果
(1)溫和條件下對底物進行一般脫氨基處理
研究者在溫和條件下對多種核苷酸底物進行了脫氨基反應,發現甘油醛與硼酸三氟化物乙醚(BF3·OEt2)組合能高效脫氨基廣泛的核苷酸底物。通過改變羰基催化劑,從二羰基有機催化劑改為單羰基有機催化劑(如糠醛),可以顯著提高鳥苷類似物的脫氨基產率。研究者推測這可能是因為鳥苷類似物在位置6處可以與甘油醛環化,形成鳥苷-甘油醛加合物。

圖2:由有機催化劑與路易斯酸共同催化的核苷酸脫氨基反應。
a-c. 以胞嘧啶(a)、腺苷(b)和鳥苷(c)及其類似物為底物的脫氨基反應范圍。d. 在優化的催化條件下,對甲基化核苷進行反應。
(2)闡明反應機制
通過15N核磁共振(NMR)光譜學跟蹤反應過程,研究者發現,在沒有路易斯酸的情況下,15N6腺苷與甘油醛的縮合反應非常緩慢,即使在50℃下加熱2小時后,縮合產物的形成仍然很少。然而,加入BF3·OEt2后,15N標記的腺苷在半小時內迅速轉化為中間體Int 3。二維1H-15N HMBC光譜學被用來監測路易斯酸催化的縮合反應,具有更高的15N靈敏度。在Na15NO2存在的情況下,15N亞胺信號消失,表明其轉化為脂肪族硝基取代的中間體,并隨后重排為N-亞硝化加合物。這些結果證實了通過亞胺中間體的反應路徑。

圖3:反應機制研究與催化循環。
a. 15N6腺苷脫氨基反應的一維15N核磁共振(NMR)譜圖。b. 提出的脫氨基反應的催化循環。
(3)DNA和RNA中腺苷脫氨基的選擇性條件
研究者進一步探索了優化CAM-seq選擇性條件,使其對腺苷的脫氨基反應具有更高的選擇性。通過測試不同的路易斯酸,發現硼酸在提高反應活性方面最為有效。在硼酸存在的情況下,二羰基化合物比單羰基化合物具有更高的脫氨基效率。通過液相色譜-串聯質譜(LC-MS/MS)分析,甘油醛和三氟丙醛都表現出對腺苷的選擇性,但由于三氟丙醛導致的顯著DNA/RNA降解,研究者選擇了甘油醛進行進一步研究。在優化的脫氨基條件下,甘油醛在DNA和RNA中都表現出對腺苷的完全脫氨基反應,而m6A位點保持不變。

圖4:在寡核苷酸中優化脫氨基條件。
a-b.在不同路易斯酸催化劑(a)和羰基有機催化劑(b)條件下,寡核苷酸中腺苷位點的突變比率。硼酸(紅色輪廓)和甘油醛(藍色輪廓)催化劑被選中進行進一步優化(n=4)。c.不同羰基有機催化劑對A和C脫氨基的催化效率比較。二羰基催化劑在A位點的轉化率高于C位點。
d.在優化條件下,6堿基DNA寡核苷酸CTCAGC表現出對G保護和A脫氨基的高反應性。
e.使用5堿基m6A RNA寡核苷酸探針(ACm6AGU),在與d相似條件下展示A和m6A的選擇性。
f-h. LC–MS/MS監測DNA寡核苷酸脫氨基反應中甘油醛(f)、硼酸(g)和亞硝酸鹽(h)濃度的優化(n=3)。
i-k. LC–MS/MS監測RNA寡核苷酸脫氨基反應中甘油醛(i)、硼酸(j)和亞硝酸鹽(k)濃度的優化(n=3)。
(4)CAM-seq m6A檢測的優化條件
研究者注意到,盡管甘油醛作為一種有機催化劑非常有效,但它傾向于與鳥苷形成加合物,這可能導致逆轉錄酶在逆轉錄過程中停止(RT stops)。因此,研究者選擇了kethoxal作為保護基團,因為它具有更高的反應速率和更好的可逆性。在優化條件下,CAM-seq能夠在接近中性的pH值下進行,顯著減少RNA降解。通過測試11種不同的逆轉錄酶和3種不同的dNTP比例(dTTP/dCTP比例為1:1、1:40和1:400),研究者發現RevertAid RT在dTTP/dCTP比例為1:40時,背景噪聲水平最低,約為0.36%。

圖5:CAM-seq 協議的優化。
a. 使用甘油醛保護的G位點的RNA寡核苷酸探針測試了逆轉錄(RT)停止情況。b. 使用kethoxal保護的RNA寡核苷酸探針在與a相似的條件下展示了RT停止比率。
c-f. 在中性條件下,使用甘油醛(c,d)和kethoxal(e,f)對DNA寡核苷酸的籠化(caging)(c,e)和去籠化(decaging)(d,f)動態比較。
g. 在中性條件下,甘油醛對kethoxal完全籠化的DNA寡核苷酸的競爭。
h-i. 使用完整的RNA(h)和200個核苷酸片段化的RNA(i)進行RNA降解實驗。
j. 通過插入寡核苷酸測序數據優化逆轉錄酶條件。測試了11種逆轉錄酶和3種dTTP/dCTP比例(1:1、1:40和1:400)。一個突出的條件(RevertAid RT在1:40比例下)顯示出低于0.36%的背景噪聲水平。
(5)人、擬南芥、玉米等不同物種轉錄組中的m6A全面圖譜
使用優化的CAM-seq協議,研究者在人類HEK293T細胞系中鑒定了282281個高度可信的m6A位點(P<0.001)。其中,235173個和180056個位點的修飾比例分別大于5%和10%。GAC motif最為富集,占HEK293T轉錄組中可信位點的54%,其次是AAC motif,占27%。值得注意的是,YAC(CAC/UAC)和RAU(GAU/AAU)motif,這些與RAC motif僅相差一個核苷酸的motif,也顯示出一定程度的m6A修飾。在人類轉錄組中,m6A富集的motif(如GAC)在3'-UTR區域的終止密碼子附近表現出明顯的富集信號,進一步證實了CAM-seq能夠提供整個轉錄組的高質量m6A圖譜。
研究者還對擬南芥和玉米的RNA樣本進行了分析,發現RAC motif在這些植物中也是最富集的m6A修飾motif。然而,與人類樣本不同的是,RAC motif僅占植物中所有m6A位點的40%,而在人類樣本中約為85%。此外,植物中AAC motif豐度最高,而在人類中則是GAC motif豐度最高。這些結果表明,植物中的m6A修飾模式與人類存在差異,可能與植物中m6A修飾的調控機制有關。

圖6:m6A修飾的精確定量揭示了在motif水平上的m6A沉積。
a. 所有A位點(覆蓋度>20)的m6A修飾水平分布,以GAC和UAG motif為例。b. 多種方法檢測到的m6A位點與估計背景噪聲的比較。
c. CAM-seq和GLORI-seq在126362個重疊位點上m6A水平的相關性(r=0.883)。紅色虛線表示相等水平。紅色三角形標記的區域突出了GLORI-seq高估m6A水平的位點。
d. 在三種基于脫氨基的方法中觀察到的所有m6A位點中,AAC motif的比例,計算為所有位點的(m6A比率×覆蓋率)之和與所有位點的(m6A比率×覆蓋率)之和的比值。
e. 人類樣本中所有A位點(無過濾)的平均甲基化水平與相對motif頻率的關系。GAC和AAC motif(紅色)高于背景水平。整體m6A水平表示為0.41%。
f-g. 擬南芥(f)和玉米(g)中所有A位點的平均甲基化水平與相對motif頻率的關系。整體m6A水平分別表示為0.77%和0.69%。
h. 人類、擬南芥和玉米中通過過濾的16 three-letter motif的頻率與平均甲基化水平之間的關系。
i-k. 人(i)、擬南芥(j)和玉米(k)中相對于m6A位點的每個位置核苷酸重要性評分。
(6)飽和分析將轉錄速率與m6A水平關聯分析
研究者通過飽和m6A圖譜分析發現,基因表達水平與平均m6A水平呈負相關。具體來說,高轉錄率基因傾向于具有較低m6A水平,可能是由于m6A沉積復合物的可用性有限,或者甲基轉移酶復合物與轉錄機制在細胞內的動態關聯。此外,研究者還發現,基因的最大m6A修飾水平可以作為區分基因的一個重要參數。將基因分為兩組:一組是所有m6A位點的修飾水平普遍較低的基因,另一組是具有高修飾潛力的基因。這兩組基因的表達水平與m6A水平都呈現出顯著的負相關性。

圖7:影響m6A變化的因子。
a. 插圖展示了A位點的區域和基因分布如何影響基因中m6A修飾水平的變異。b. 基于meta基因分析,終止密碼子附近的-20到+180核苷酸區域被確定為m6A沉積的熱點區域。
c. 基因間和單個基因內的變異對應數據。
d. log10基因表達水平與平均m6A水平之間的關系,以等高線圖表示,并帶有虛線趨勢線。
e. 所有基因的最大m6A修飾水平分布。低甲基化和高甲基化組的擬合曲線分別用藍色和紅色虛線標記。
f. 基因內平均m6A修飾水平與最大m6A修飾水平之間的相關性。
g-h. 僅低修飾基因(g)和僅高修飾基因(h)的log10基因表達水平與平均m6A水平之間的關系。
i. 所有基因(黑色)、無m6A修飾基因(藍色)、低m6A修飾基因(黃色)和高m6A修飾基因(紅色)的m6A水平與基因表達之間的總體關系。
CAM-seq、NO-seq、NT-seq、GLORI、MeRIP-seq等m6A測序方法介紹及比較
(1)CAM-seq(化學協同催化輔助的m6A測序)
原理:通過化學協同催化策略,利用羰基催化劑和路易斯酸催化劑的協同作用,將RNA中的腺苷(A)轉化為次黃嘌呤(I),而m6A位點抵抗脫氨基反應,保持為腺苷。通過逆轉錄酶或DNA聚合酶讀取時,I被讀作鳥嘌呤(G),從而實現m6A檢測。
優點:
溫和條件:反應在接近中性的pH值下進行,避免了RNA降解。
低背景噪聲:背景噪聲低至0.5%,遠低于其他方法。
低輸入量:僅需10ng的RNA輸入即可實現高分辨率檢測。
高靈敏度:能夠檢測到低比例的m6A修飾位點。
應用場景:
適用于低輸入量的RNA樣本,如單細胞RNA測序、微量組織樣本等。
(2)NO-seq(硝酸鹽介導的m6A測序)
原理:通過硝酸鹽離子介導的化學脫氨基反應,將RNA中的腺苷(A)轉化為次黃嘌呤(I),從而實現m6A的檢測。
優點:
操作簡單:不需要復雜的酶反應步驟。
成本低:試劑成本較低。
缺點:
反應條件苛刻:需要在酸性條件下進行,可能導致RNA降解。
背景噪聲高:由于反應不完全,背景噪聲較高,影響檢測準確性。
(3)NT-seq(硝酸鹽介導的轉錄組測序)
原理:與NO-seq類似,通過硝酸鹽離子介導的化學脫氨基反應,將RNA中的腺苷(A)轉化為次黃嘌呤(I),從而實現m6A的檢測。
優點:
操作簡單:不需要復雜的酶反應步驟。
成本低:試劑成本較低。
缺點:
反應條件苛刻:需要在酸性條件下進行,可能導致RNA降解。
背景噪聲高:由于反應不完全,背景噪聲較高,影響檢測準確性。
(4)GLORI(化學保護基團介導的m6A測序)
原理:通過化學保護基團(如甘油醛)保護鳥苷(G),然后進行化學脫氨基反應,將RNA中的腺苷(A)轉化為次黃嘌呤(I),從而實現m6A的檢測。
優點:
選擇性高:通過保護基團的選擇性保護,提高了脫氨基反應的選擇性。
高靈敏度:能夠檢測到低比例的m6A修飾位點。
缺點:
反應條件苛刻:需要在酸性條件下進行,可能導致RNA降解。
背景噪聲高:由于保護基團的不完全去除,可能導致背景噪聲較高。
高輸入量:需要較多的RNA輸入量(通常為微克級別)。
(5)MeRIP-seq(m6A免疫沉淀測序)
原理:通過特異性的m6A抗體對RNA進行免疫沉淀,然后通過高通量測序檢測m6A修飾位點。
優點:
全轉錄組:能夠實現全轉錄組的m6A檢測。
廣泛適用:適用于多種類型的RNA樣本。
缺點:
高輸入量:需要較多的RNA輸入量(通常為微克級別)。
背景噪聲高:由于抗體的非特異性結合,可能導致背景噪聲較高。
操作復雜:需要進行免疫沉淀步驟,操作較為復雜。
參考文獻:
Wang, P., Ye, C., Zhao, M. et al. Small-molecule-catalysed deamination enables transcriptome-wide profiling of N6-methyladenosine in RNA. Nat. Chem. (2025). https://doi.org/10.1038/s41557-025-01801-3
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





