DC(樹突狀細胞)的制備方法
【背景】
DC 是「Dendritic Cells」的縮寫,中文全稱為「樹突狀細胞」,因其成熟時伸出 許多樹突樣或偽足樣突起而得名。DC 是由 2011 年諾貝爾獎獲得者、加拿大 籍科學家 Ralph M. Steinman 于 1973 年發現的,是目前發現的功能最強的抗原遞呈細胞 (Antigen Presenting Cells, APC)。已證實,DC 是唯一能夠顯著刺激初始 T 細胞(Naïve T cells)增殖的 APC,而其它種類的 APC(如單核巨噬細胞,B 細胞等)僅能刺激已活化 的或記憶性的 T 細胞,因此 DC 是機體適應性 T 細胞免疫應答的始動者,在腫瘤免疫中發揮著極其重要的作用。
【培養原理】
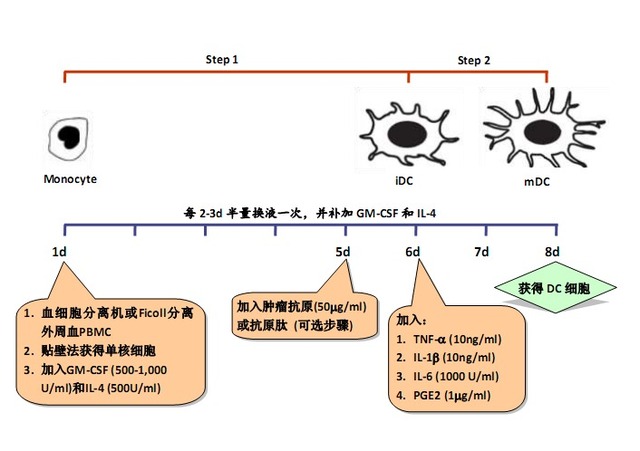
因為 DC 需從其它種類細胞誘導分化而來,且可分為不同的成熟階段,所以通常分為 2 個步驟進行培養:
Step 1:從 DC 的祖細胞(如單核細胞)誘導分化為未成熟 DC(immature DC,iDC);
Step 2:從 iDC 誘導分化為成熟 DC(mature DC,mDC)。
Step 1:
GM-CSF(粒細胞巨噬細胞集落刺激因子):
GM-CSF 是一種造血生長因子,在體外可刺激中性粒細胞和巨噬細胞集落的形成, 并具有促進早期紅巨核細胞、嗜酸性祖細胞增殖和發育的功能。GM-CSF 是最早被鑒定 出對 DC 培養有作用的細胞因子之一。
GM-CSF 在 DC 培養中的功能是促進單核細胞向大巨噬樣細胞分化,細胞表面 MHC II 類分子的表達得以提高,從而增強細胞的抗原遞呈功能。此外,GM-CSF 也可促進 DC 的存活。
IL-4(白細胞介素-4)
IL-4 在由單核細胞誘導成 DC 的過程中發揮的作用是抑制巨噬細胞的過度生長,從 而引導單核細胞向 DC 方向分化。 若培養體系中不加 IL-4,單核細胞將分化為巨噬細 胞。同時,IL-4 還有降低細胞表面表達 CD14 分子的能力。CD14 表達水平的降低是單 核細胞分化為 DC 的重要標志。
GM-CSF 和 IL-4 共同作用可使單核細胞定向分化為未成熟 DC,此時的 DC 具有較 強的抗原攝取和加工能力,但抗原遞呈能力很弱。細胞表面中度表達 MHC I 類、II 類 分子和 B7 家族分子(CD80, CD86 等),但不表達或低表達 CD14。
Step 2:
TNF-α/IL-1β/ IL-6(腫瘤壞死因子-α/白細胞介素-1β/白細胞介素-6)
TNF-α,IL-1β和 IL-6 均為促炎癥因子,在感染局部和腫瘤部位被誘導產生。體外 研究表明,這 3 種細胞因子均可下調未成熟 DC 的巨胞飲作用和表面 Fc 受體的表達, 使細胞內 MHC II 類分子區室(class II compartment)消失,但能夠上調細胞表面 MHC I 類、II 類分子和 B7 家族分子(CD80, CD86 等)的表達, 使未成熟 DC 分化為成熟 DC, 此時 DC 的抗原攝取和加工能力明顯減弱,而抗原遞呈能力顯著增強,可極強地激活 T 細胞。
TNF-α/IL-1β/IL-6 三因子組合可在無牛血清培養條件下誘導 DC 的完全成熟,從而 制備出可以應用于臨床的 DC。
PGE2(prostaglandin E2,前列腺素 E2)
PGE2 也是炎性介質,可由 TNF-α,IL-1 和 LPS(脂多糖)等炎癥信號誘導產生。在
TNF-α/IL-1β/IL-6 成熟誘導組合中添加 PGE2,可進一步提高 DC 的產量、成熟度、遷 移能力和免疫激活能力。
這里尤為重要的是 DC 遷移能力的提高。因為 TNF-α/IL-1β/IL-6 誘導成熟的 DC 遷 移能力較弱,不能很好地到達淋巴結而激活 T 細胞。而添加 PGE2 后誘導成熟的 DC 因 表面趨化因子受體的高表達,而更容易遷移至淋巴結,而引起機體對抗腫瘤的免疫反應。
因此,TNF-α/IL-1β/IL-6/PGE2 組合(見下表)廣泛應用于臨床,并被認為是制備成熟 DC 的「金標準」
| 組份 | 工作濃度 |
| TNF-a | 10ng/ml |
| IL-1β | 10ng/ml |
| IL-6 | 1000 U/ml |
| PGE2 | 1mg/ml |
【注意事項】
1.DC 的來源:
DC有多種來源,包括外周血單核細胞(Monocyte)、臍帶血 CD34+細胞、骨髓和胎 肝等,但因外周血單核細胞最容易獲取、數量也最多,所以臨床上被廣泛用作 DC 的來源細胞。
2.DC 的成熟度:
我們知道,DC 有未成熟和成熟兩種狀態,即 iDC 和 mDC,而 DC 的抗原遞呈能力 與其成熟狀態密切相關。
iDC 的抗原攝取和加工能力較強,但抗原遞呈能力很弱。在體外培養時,iDC 去除 細胞因子(即 GM-CSF 和 IL-4)后,會逆轉為巨噬細胞,且即使在細胞因子的維持下,未 成熟 DC 的功能也不是激活 T 細胞,而是抑制 T 細胞的增殖。
mDC 則正好相反,其抗原攝取和加工能力很弱,但具有很強的抗原遞呈能力。因 而可以激活 T 細胞,引起免疫反應。而且 DC 成熟后即使在培養體系中去除細胞因子, 仍能保持 DC 的狀態和功能,不會發生逆轉。
因此可以看出,DC 必須完全成熟后才能用于免疫治療。
3.DC 的無牛血清培養:
DC 最初都是在含有小牛血清(Fetal Calf Serum,FCS)的培養體系中獲得的,但我們 知道,如果想將 DC 應用于臨床治療,則不能使用 FCS。然而如果不用 FCS,DC 則無 法培養成功。科學家最先想到的是用 10%的人自體血漿來替代 10%的 FCS,但實驗結果表明,人單核細胞在含 10%人自體血漿的培養液中培養,用 GM-CSF 和 IL-4 誘導 7 天后,大多 數單核細胞仍貼壁,半懸浮的 iDC 數量非常少。后來經過不斷摸索發現,在無血清培 養基中添加 1%人自體血清對于從單核細胞誘導成為 iDC 效果最好。更為困難的步驟是如何在無牛血清培養體系中將 iDC 誘導成為 mDC。TNF-α和 IL-1β 在含牛血清培養體系中均是很好的 DC 成熟誘導劑,而在無牛血清培 養體系中,兩者均無效或效果微弱,即在無牛血清清培養體系,TNF-α和 IL-1不能將 iDC 誘導成為 mDC,或僅能誘導一小部分 iDC 成為 mDC。
后來的研究表明,用單核細胞條件培養基(Monocyte-conditioned medium,MCM), 即單核細胞在包被有免疫球蛋白的細菌平皿上無牛血清培養 24 小時后得到的培養上清, 可在無牛血清培養體系中誘導 DC 的完全成熟。因此認為,1%人自體血漿+ MCM 可能 成為臨床上獲得成熟 DC 的標準方法。
但每次制備的 MCM 的一致性很難保證,導致每批 MCM 必須經過測試后才能確定 最適用量,這給臨床應用帶來阻力和不穩定性。所以,人們一直想尋找到能夠替代 MCM 的化學成分明確的成熟誘導組合。
1997 年,德國美因茨大學(Mainz University)的 Jonuleit 等取得了突破性進展,他們 發現 TNF-α,IL-1β 和 IL-6 三種細胞因子的組合可完全替代 MCM,在無牛血清培養體 系中能夠將 iDC 誘導成完全成熟的 DC。
4. PGE2 與 DC:
德國美因茨大學的 Jonuleit 在證明 TNF-α,IL-1β 和 IL-6 三種促炎癥因子的組合可 完全替代 MCM,在無牛血清培養體系中能夠將 iDC 完全誘導成熟的同時,也發現另一 種炎癥介質,即 PGE2 可進一步提高 DC 的產量、成熟度、遷移能力和免疫激活能力, 也就是說在 TNF-α,IL-1β 和 IL-6 之外添加 PGE2 可獲得更為成熟和高效的 DC,這樣 會提高臨床上 DC 的治療效果。
PGE2 常被加入 DC 成熟誘導組合中最重要的原因是其可提高成熟 DC 的遷移能力, 這樣可使 DC 更容易到達淋巴結,從而引起免疫反應、治療腫瘤。但我們也應該注意以下幾點:
1) PGE2 不能添加到 DC 誘導分化的 Step 1 中,如加入,DC 的分化將會被抑制;
2) 我們知道,能誘導機體產生 Th1 反應的 DC(很多文獻中稱為 DC1)有助于多種 腫瘤,如黑色瘤和惡性膠質瘤等的治療。
實驗研究表明,在成熟誘導因子(TNF-α/IL-1β)中加入 PGE2 傾向于將 iDC 誘導 成為成熟的 DC2,而非 DC1,該 DC 會誘導產生 Th2 反應。所以很多人在試圖 尋找能夠誘導 DC1 的最佳成熟誘導組合,如 TNF-α/IL-1β/IFN-α/IFN-γ/poly-I:C, TNF-α/IL-1β/IFN-γ/PGE2(低濃度)/R848(TLR7/8 激動劑)和 IFN-γ/LPS 序貫組合 等,但這些新組合都未得到臨床上的充分驗證,也就沒有真正用于臨床級別 DC 的制備。
3) 其實,各家的研究結果不盡相同。比如,TNF-α/IL-1β/IL-6/PGE2 組合的創立者
---德國美因茨大學的 Jonuleit 在研究時就發現,添加 PGE2 誘導成熟的 DC 在刺 激 T 細胞時可顯著提高其分泌的 IFN-γ 產量,而對 IL-4 和 IL-10 的分泌無影響, 提示添加 PGE2 誘導成熟的 DC 具有誘導 Th1 反應的傾向。
總之,培養體系中是否加入小牛血清,以及所使用的無血清培養基種類不同等諸多 因素都可能導致添加 PGE2 誘導成熟的 DC 在性質上的差異,因此臨床上制備 DC 時最 好能夠做充分的前期研究,然后確定用于治療某種腫瘤最好的制備方法。
【DC的制備】
1. 外周血單個核細胞的采集
1.1 用血細胞分離機采集患者自身的外周血單個核細胞 80 - 100ml;
1.2 淋巴細胞分離液密度梯度離心法進一步純化單個核細胞(PBMC)。
1.3 無血清培養液洗滌 2 次,獲得純度在 90%以上的 PBMC,細胞數量需達到 1-3 x 108。
2. (可選步驟) 腫瘤抗原的制備
用于負載 DC 的腫瘤抗原可以是腫瘤特異性抗原肽(Tumor-Specific Antigens, TSA)或腫瘤相關抗原(Tumor-Associated Antigens, TAA),也可以是腫瘤全細胞抗原。
用 TSA 或 TAA 負載的 DC 具有很好的靶向性,但該方法具有已確定的腫瘤特異性 抗原或抗原肽種類少和單一抗原的免疫攻擊經常無法殺傷腫瘤細胞等缺陷。而用腫瘤全 細胞抗原負載 DC 可克服這些缺陷,因為此時無需知道哪些抗原是腫瘤細胞的 TSA 或 TAA,而且全抗原中的多種不同腫瘤抗原沖擊 DC 可誘導產生針對不同抗原決定簇的細 胞毒 T 淋巴細胞(CTL)克隆,從而實現對腫瘤細胞的有效殺傷。
腫瘤細胞全抗原負載 DC 的方法很多,包括用腫瘤細胞裂解液負載 DC、用凋亡腫 瘤細胞負載 DC、用壞死或死亡的腫瘤細胞負載 DC,用腫瘤活細胞負載 DC,和將腫瘤 細胞與 DC 融合等。目前臨床上常用的是用腫瘤細胞裂解液負載 DC,因該方法簡單、 快速、有效。
反復凍融是獲得腫瘤細胞裂解液的常見方法,具體步驟如下:
2.1 手術切除腫瘤標本,無菌條件下,將壞死組織和癌旁非腫瘤組織去除干凈;
2.2 無菌生理鹽水洗 3 次;
2.3 用無菌的組織剪將腫瘤組織剪碎,加入 RPMI 1640 培養基,充分研磨;
2.4 200 目無菌網過濾后收集單細胞懸液;
2.5 用 RPMI 1640 培養基重懸細胞至 1-2 x 107/ml,裝入 5ml 無菌凍存管中;
2.6 將凍存管浸入液氮中速凍,10 min 后取出,再迅速放入 37oC 水浴中解凍 10 min。 反復 3-5 次;
注:也可以-80oC/37oC 反復凍融 3-5 次。
2.7 將腫瘤裂解物加入離心管中,3000rpm,離心 10min;
2.8 收集上清,0.22m 濾膜過濾除菌,留樣檢測蛋白含量及細菌、真菌和支原體;
2.9 -80oC 保存備用。
3. DC 細胞的培養及鑒定
3.1 步驟 1 中獲得的 PBMC 用無血清培養液調整細胞濃度至 2 x 106/ml,置于培養瓶內;
3.2 37℃,5% CO2 培養箱中孵育 2h,以使單核細胞貼壁;
3.3 洗去懸浮細胞,在貼壁細胞中加入含重組人 GM-CSF(500-1,000U/ml)和重組人 IL-4 (500U/ml)的無血清培養液,37℃,5% CO2 培養箱中培養,誘導單核細胞向 DC 細 胞分化;
3.4 每 2-3d 半量換液一次,并補足細胞因子;
3.5 (可選步驟) 在培養的第 5d, 加入步驟 2 中獲得的腫瘤抗原 50 μg/ml,對 DC 進行 抗原負載;
注:若不對 DC 進行抗原負載,該步省略。
3.6 在培養的第 6d,加入重組人 TNF-α(10ng/ml),IL-1β(10ng/ml),IL-6(1000U/ml)和 PGE2(1μg/ml),誘導 DC 細胞成熟;
3.7 在培養的第 7d 或第 8d,收獲 DC 細胞,其數量應達到 1×106 個以上;
3.8 DC 的質檢:
3.8.1 活細胞比例:臺盼藍染色驗證活細胞應在 90%以上;
3.8.2 形態學觀察:>90%細胞半懸浮,細胞有多個樹突樣突起;
3.8.3 細胞表型分析(見下圖):流式細胞術檢測 DC 細胞表面 CD14、HLA-DR、 CD40、CD80、CD83 和 CD86 等分子的表達,成熟的 DC 不表達 CD14, 而高表達其他分子。CD83 是成熟 DC 的特異性標志,在單核細胞和不成熟 DC 表面不表達或低表達。
3.8.4 無菌檢測:收獲細胞前取少量培養物進行細菌、真菌培養,并檢測支原體、 衣原體,均應為陰性;
3.8.5 內毒素檢測:收獲細胞前取少量培養物,回輸前,用鱟試劑檢測內毒素含量, 標準:內毒素<0.5 EU/ml。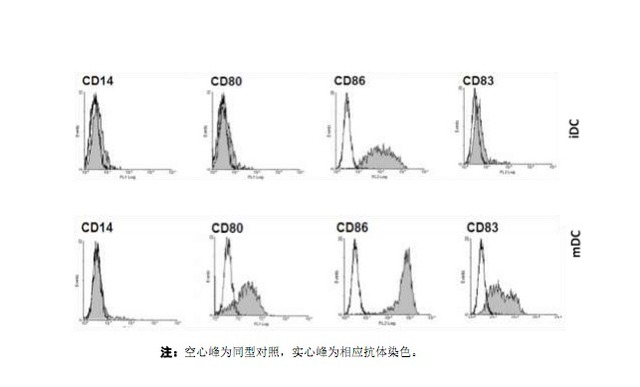
【DC 培養試劑推薦】
生產商
產品名稱
產品編號
產品規格
使用濃度
PeproTech
重組人 GM-CSF (Animal Free)
AF-300-03
5mg/20mg/50mg/100mg/250mg/500mg/1mg
50-100ng/ml
PeproTech
重組人 IL-4 (Animal Free)
AF-200-04
5mg/20mg/50mg/100mg/250mg/500mg/1mg
100ng/ml
PeproTech
重組人 TNF-a (Animal Free)
AF-300-01A
10mg/50mg/100mg/250mg/500mg/1mg
10ng/ml
PeproTech
重組人 IL1-b (Animal Free)
AF-200-01B
2mg/10mg/50mg/100mg/250mg/500mg/1mg
10ng/ml
PeproTech
重組人 IL-6 (Animal Free)
AF-200-06
5mg/20mg/50mg/100mg/250mg/500mg/1mg
100ng/ml
PeproTech (BioGems)
PGE2 (前列腺素 E2)
3632464
10mg/50mg
1mg/ml
注:Animal Free 意為無動物成分。無動物成分的重組細胞因子在生產過程中不會有任何動物源性物質,尤其是牛的病原體和蛋白的混 入,使得最終獲得的重組人蛋白中不含任何動物成分。這樣可避免動物病原體(如瘋牛病,克雅氏病等)的污染及外源蛋白引起的機體異種排斥和過敏反應,因此細胞治療的體外細胞培養過程中最好使用無動物成分的重組細胞因子。
【DC 鑒定試劑推薦】
| 生產商 | 產品名稱 | 產品編號 | 克隆號 | 熒光標記 | 產品規格 |
| PeproTech (BioGems) | 抗人 CD14 熒光標記抗體 | 6211 | 61D3 | FITC/PE/APC/PerCP-Cy5.5 | 25tests/100test |
| 抗人 CD40 熒光標記抗體 | 2511 | 5C3 | FITC/APC | 25tests/100test | |
| 抗人 CD80 熒光標記抗體 | 2911 | 2D10.4 | FITC/PE | 25tests/100test | |
| 抗人 CD83 熒光標記抗體 | 5911 | HB15e | FITC/PE | 25tests/100test | |
| 抗人 CD86 熒光標記抗體 | 8911 | IT2.2 | PE | 25tests/100test | |
| 抗人 HLA-DR 熒光標記抗體 | 74111 | LN3 | FITC/PE/APC/PerCP-Cy5.5 | 25tests/100test |
注:用于 DC 鑒定的表面標志物的表達在流式圖上均呈現單個峰,且多數情況下不能與陰性峰完全區分開來。為避免多色分析時補償調 節不好導致結果的不準確性,建議最好用單標,最多用雙標來做 DC 表面標志的分析,而且必須使用同型對照,而非空白細胞對照來 排除背景染色。
【參考文獻】
[1] Steinman RM, Cohn ZA. Identification of a novel cell type in peripheral lymphoid organs of mice. I. Morphology, quantitation, tissue distribution. J. Exp. Med. 1973; 137 (5): 1142–62.
[2] Bender A, Sapp M, et. al. Improved methods for the generation of dendritic cells from nonproliferating progenitors in human blood. J Immunol Methods. 1996; 196(2):121-35.
[3] Romani N, Reider D, et. al. Generation of mature dendritic cells from human blood. An improved method with special regard to clinical applicability. J Immunol Methods. 1996; 196(2):137-51.
[4] Jonuleit H, Kühn U, et al. Pro-inflammatory cytokines and prostaglandins induce maturation of potent immunostimulatory dendritic cells under fetal calf serum-free conditions. Eur J Immunol. 1997; 27(12):3135-42.
[5] Datta J, Terhune JH, et al. Optimizing dendritic cell-based approaches for cancer immunotherapy. Yale J Biol Med. 2014; 87(4):491-518.
[6] de Jong EC, Vieira PL, et al. Microbial compounds selectively induce Th1 cell-promoting or Th2 cell-promoting dendritic cells in vitro with diverse th cell-polarizing signals. J Immunol. 2002 Feb 15;168(4):1704-9.
[7] 張志偉,宋鑫。DC-CIK 細胞臨床制備規范化研究。中國腫瘤,2011;20(2):85-88。





