臍帶間充質干細胞衍生小細胞外囊泡減輕輻射誘導的心臟類器官損傷研究
研究背景:
通常心臟被認為是耐輻射器官。然而,胸部惡性腫瘤放療出現的心臟副作用使放射性心臟損傷受到越來越多的關注。RIHD會對心臟結構、傳導系統和循環系統造成不可逆損傷。目前,盡管他汀類藥物(羥甲基戊二酰輔酶A還原酶抑制劑)、血管緊張素轉換酶抑制劑(ACEIs)和抗氧化劑在減輕輻射誘導的心臟損傷方面有效,但手術干預仍不可避免。因此,迫切需要開發針對 RIHD 的有效治療方法。
小細胞外囊泡(sEVs)最初被認為是源自血小板和紅細胞的細胞殘余物,但其在組織修復、再生、信號傳導和誘導細胞分化方面的潛力已引起研究人員的日益關注。臍帶間充質干細胞來源的sEVs(UCMSCs-sEVs)可減輕纖維化、抑制炎癥反應、抑制氧化應激損傷、促進組織修復并減少細胞凋亡。這些綜合優勢是單一藥物治療無法比擬的。UCMSCs-sEVs已在膜增生性腎小球腎炎、肝缺血-再灌注損傷和骨關節炎相關軟骨損傷等多種疾病中顯示出治療效果且無不良反應。值得注意的是,目前關于sEVs用于治療RIHD的研究尚屬匱乏。
基于此,軍事醫學研究院王華教授團隊與檀英霞教授團隊近期在Stem Cell Research & Therapy雜志上發表"Small extracellular vesicles derived from umbilical cord mesenchymal stem cells alleviate radiation-induced cardiac organoid injury"相關文章。

研究方法:
本研究通過使用高分辨熒光標測技術(Optical Mapping)對不同組類器官鈣信號活動的速度、離散度、振幅、頻率及復極時間等指標進行檢測,探究UCMSCs-sEVs對輻射損傷心臟類器官的治療作用。
研究結果:
1. 從人誘導多能干細胞(hiPSCs)構建心臟類器官
本研究參照Hofbauer等人的實驗方案,成功在體外構建心臟類器官。通過96孔U型板培養hiPSC球體,在分化30天的免疫熒光分析表明,球體內核含cTnT/MYL7陽性心肌細胞并表達心室標記IRX4,外圍包膜含CDH5/PECAM1陽性心內膜細胞及波形蛋白陽性間充質細胞,結構類似早期胚胎心室心內膜。研究證實,通過精準信號調控構建的心臟類器官兼具功能與結構特征,為心臟發育及疾病研究提供有效模型。
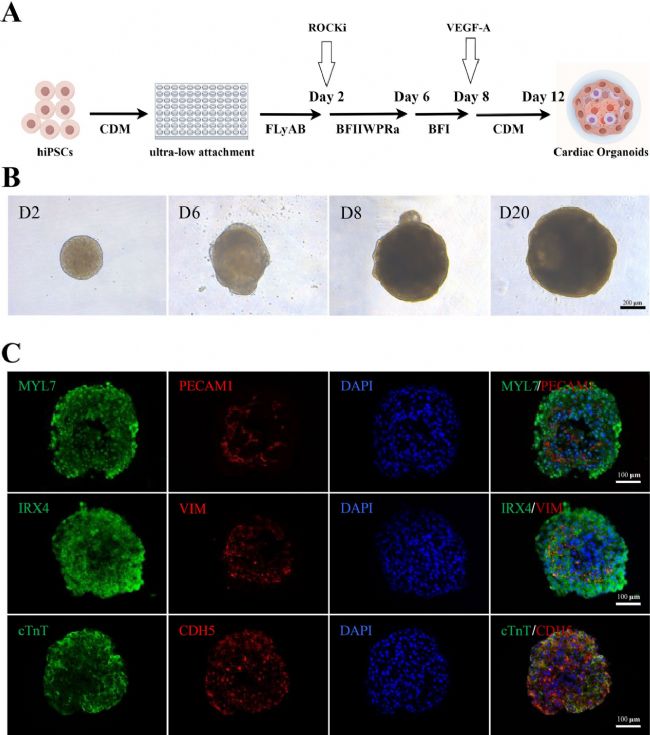
圖1 心臟類器官的制備
2. UCMSCs-sEVs的提取與鑒定
通過差速離心法從UCMSCs的上清液中提取小細胞外囊泡(sEVs)。隨后利用納米顆粒跟蹤分析(NTA)檢測UCMSCs-sEVs的粒徑分布和濃度,結果顯示其平均直徑約為138nm,濃度為5.5×10¹¹顆粒 / 毫升。透射電子顯微鏡(TEM)圖像顯示,UCMSCs-sEVs呈圓形或橢圓形,具有雙膜結構,直徑約100nm。蛋白質印跡法(WB)結果表明,sEVs表達四次跨膜蛋白CD63、CD9及腫瘤易感基因101,同時也表達其來源細胞UCMSCs的標記物CD90。
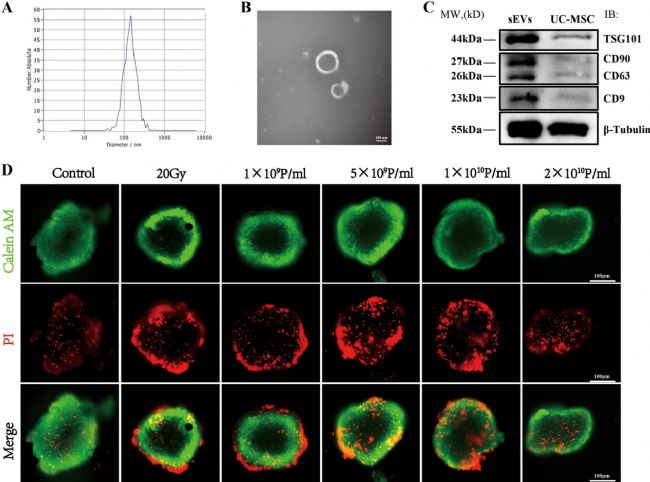
圖2 UCMSCs-sEVs的鑒定及治療濃度優化
4. UCMSCs-sEVs治療減輕了輻射損傷的心臟類器官超微結構損傷
線粒體為心臟供能,心肌纖維是心臟自主活動的功能基礎,二者是心肌細胞關鍵結構。通過TEM觀察輻射及UCMSCs-sEVs治療后心臟類器官超微結構,發現輻射導致肌纖維排列紊亂、線粒體顯著自噬及空泡化(內膜褶皺減少),肌原纖維長度異常增加。UCMSCs-sEVs治療組中,以上現象被抑制。研究表明,UCMSCs-sEVs通過修復線粒體和心肌纖維超微結構損傷,減輕輻射對心臟類器官的結構性破壞,為其治療放射性心臟損傷提供細胞學依據。
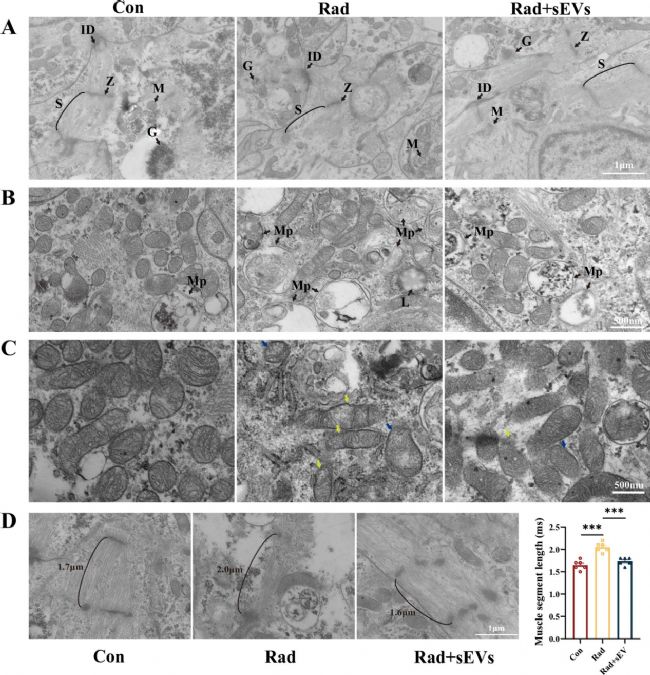
圖4 輻射和UCMSCs-sEVs治療后心臟類器官的超微結構特征
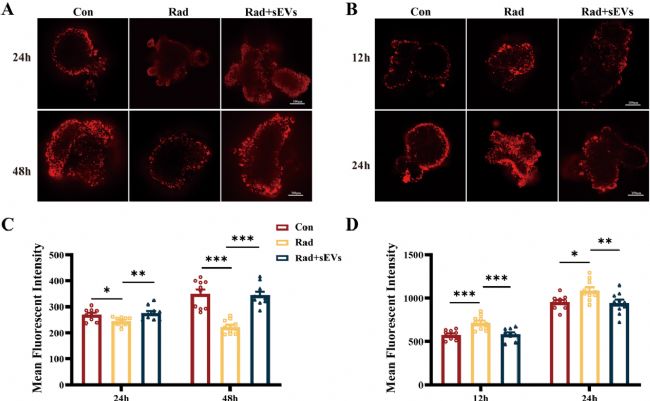
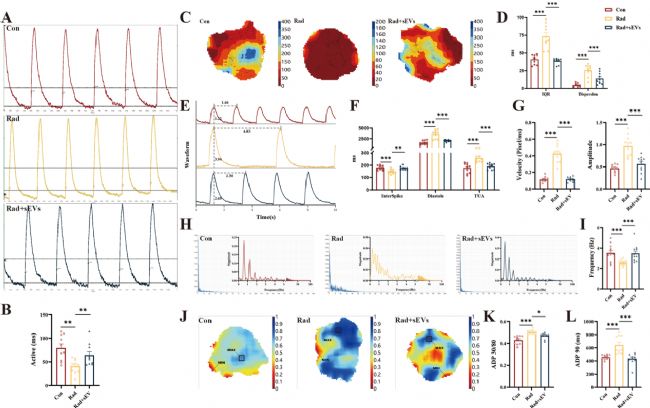
圖6 UCMSCs-sEVs恢復了輻射損傷的心臟類器官的正常鈣瞬變
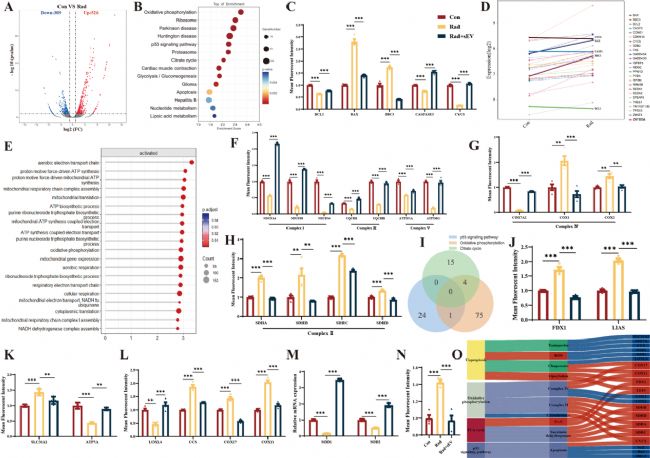
圖8 UCMSCs-sEVs在輻射誘導的心臟類器官損傷中的潛在作用機制
通常心臟被認為是耐輻射器官。然而,胸部惡性腫瘤放療出現的心臟副作用使放射性心臟損傷受到越來越多的關注。RIHD會對心臟結構、傳導系統和循環系統造成不可逆損傷。目前,盡管他汀類藥物(羥甲基戊二酰輔酶A還原酶抑制劑)、血管緊張素轉換酶抑制劑(ACEIs)和抗氧化劑在減輕輻射誘導的心臟損傷方面有效,但手術干預仍不可避免。因此,迫切需要開發針對 RIHD 的有效治療方法。
小細胞外囊泡(sEVs)最初被認為是源自血小板和紅細胞的細胞殘余物,但其在組織修復、再生、信號傳導和誘導細胞分化方面的潛力已引起研究人員的日益關注。臍帶間充質干細胞來源的sEVs(UCMSCs-sEVs)可減輕纖維化、抑制炎癥反應、抑制氧化應激損傷、促進組織修復并減少細胞凋亡。這些綜合優勢是單一藥物治療無法比擬的。UCMSCs-sEVs已在膜增生性腎小球腎炎、肝缺血-再灌注損傷和骨關節炎相關軟骨損傷等多種疾病中顯示出治療效果且無不良反應。值得注意的是,目前關于sEVs用于治療RIHD的研究尚屬匱乏。
基于此,軍事醫學研究院王華教授團隊與檀英霞教授團隊近期在Stem Cell Research & Therapy雜志上發表"Small extracellular vesicles derived from umbilical cord mesenchymal stem cells alleviate radiation-induced cardiac organoid injury"相關文章。

研究方法:
本研究通過使用高分辨熒光標測技術(Optical Mapping)對不同組類器官鈣信號活動的速度、離散度、振幅、頻率及復極時間等指標進行檢測,探究UCMSCs-sEVs對輻射損傷心臟類器官的治療作用。
研究結果:
1. 從人誘導多能干細胞(hiPSCs)構建心臟類器官
本研究參照Hofbauer等人的實驗方案,成功在體外構建心臟類器官。通過96孔U型板培養hiPSC球體,在分化30天的免疫熒光分析表明,球體內核含cTnT/MYL7陽性心肌細胞并表達心室標記IRX4,外圍包膜含CDH5/PECAM1陽性心內膜細胞及波形蛋白陽性間充質細胞,結構類似早期胚胎心室心內膜。研究證實,通過精準信號調控構建的心臟類器官兼具功能與結構特征,為心臟發育及疾病研究提供有效模型。

圖1 心臟類器官的制備
2. UCMSCs-sEVs的提取與鑒定
通過差速離心法從UCMSCs的上清液中提取小細胞外囊泡(sEVs)。隨后利用納米顆粒跟蹤分析(NTA)檢測UCMSCs-sEVs的粒徑分布和濃度,結果顯示其平均直徑約為138nm,濃度為5.5×10¹¹顆粒 / 毫升。透射電子顯微鏡(TEM)圖像顯示,UCMSCs-sEVs呈圓形或橢圓形,具有雙膜結構,直徑約100nm。蛋白質印跡法(WB)結果表明,sEVs表達四次跨膜蛋白CD63、CD9及腫瘤易感基因101,同時也表達其來源細胞UCMSCs的標記物CD90。

圖2 UCMSCs-sEVs的鑒定及治療濃度優化
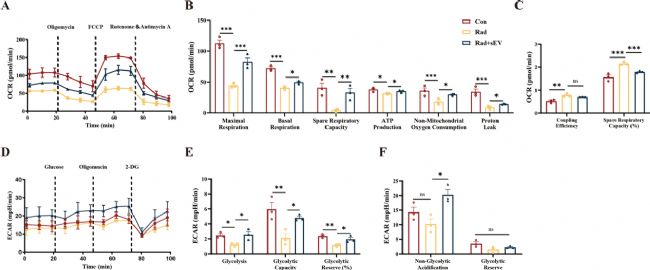
3. UCMSCs-sEVs提高了輻射損傷后心臟類器官的能量代謝能力
活/死染色顯示,20Gy X射線輻射后48小時心臟類器官損傷最顯著,優化確定UCMSCs-sEVs治療輻射損傷的最佳濃度為2×10¹⁰顆粒 / 毫升。Seahorse分析表明,輻射導致心臟類器官線粒體功能下降,而UCMSCs-sEVs干預可顯著提升其最大呼吸能力、基礎呼吸和備用呼吸能力,增強 ATP生成,恢復質子漏并調節呼吸耦合效率。此外,輻射后心臟類器官糖酵解水平及儲備能力降低,UCMSCs-sEVs治療逆轉了細胞外酸化率(ECAR)異常。綜上,UCMSCs-sEVs通過改善線粒體呼吸和糖酵解功能,減輕輻射對心臟類器官的能量代謝損傷,為放射性心臟損傷治療提供實驗依據。
活/死染色顯示,20Gy X射線輻射后48小時心臟類器官損傷最顯著,優化確定UCMSCs-sEVs治療輻射損傷的最佳濃度為2×10¹⁰顆粒 / 毫升。Seahorse分析表明,輻射導致心臟類器官線粒體功能下降,而UCMSCs-sEVs干預可顯著提升其最大呼吸能力、基礎呼吸和備用呼吸能力,增強 ATP生成,恢復質子漏并調節呼吸耦合效率。此外,輻射后心臟類器官糖酵解水平及儲備能力降低,UCMSCs-sEVs治療逆轉了細胞外酸化率(ECAR)異常。綜上,UCMSCs-sEVs通過改善線粒體呼吸和糖酵解功能,減輕輻射對心臟類器官的能量代謝損傷,為放射性心臟損傷治療提供實驗依據。

圖3 UCMSCs-sEVs提高了輻射損傷的心臟類器官的能量代謝能力
4. UCMSCs-sEVs治療減輕了輻射損傷的心臟類器官超微結構損傷
線粒體為心臟供能,心肌纖維是心臟自主活動的功能基礎,二者是心肌細胞關鍵結構。通過TEM觀察輻射及UCMSCs-sEVs治療后心臟類器官超微結構,發現輻射導致肌纖維排列紊亂、線粒體顯著自噬及空泡化(內膜褶皺減少),肌原纖維長度異常增加。UCMSCs-sEVs治療組中,以上現象被抑制。研究表明,UCMSCs-sEVs通過修復線粒體和心肌纖維超微結構損傷,減輕輻射對心臟類器官的結構性破壞,為其治療放射性心臟損傷提供細胞學依據。

圖4 輻射和UCMSCs-sEVs治療后心臟類器官的超微結構特征
5. UCMSCs-sEVs可保護心臟類器官免受輻射引起的氧化應激和線粒體損傷
采用TMRM染色評估輻射及不同時間點UCMSCs-sEVs治療后心臟類器官的線粒體膜電位(ΔΨm)。結果顯示,20Gy X射線輻射后24小時和48小時,ΔΨm(紅色熒光強度)下降,經UCMSCs-sEVs治療后恢復。通過MitoSOX染色結合共聚焦顯微鏡觀察線粒體活性氧(ROS),輻射后12小時和24小時,ROS表達顯著升高,UCMSCs-sEVs治療后ROS表達被抑制。但輻射后48小時未觀察到與12小時、24小時相同的ROS升高趨勢,推測輻射對ROS的影響可能是快速且短暫的,在輻射后期效應減弱,但輻射對ΔΨm的損傷持續存在。
采用TMRM染色評估輻射及不同時間點UCMSCs-sEVs治療后心臟類器官的線粒體膜電位(ΔΨm)。結果顯示,20Gy X射線輻射后24小時和48小時,ΔΨm(紅色熒光強度)下降,經UCMSCs-sEVs治療后恢復。通過MitoSOX染色結合共聚焦顯微鏡觀察線粒體活性氧(ROS),輻射后12小時和24小時,ROS表達顯著升高,UCMSCs-sEVs治療后ROS表達被抑制。但輻射后48小時未觀察到與12小時、24小時相同的ROS升高趨勢,推測輻射對ROS的影響可能是快速且短暫的,在輻射后期效應減弱,但輻射對ΔΨm的損傷持續存在。

圖5 UCMSCs-sEVs治療改善了輻射損傷的心臟類器官的線粒體膜電位,并降低了氧化應激
6. UCMSCs-sEVs恢復了輻射損傷心臟類器官的正常鈣瞬變
鈣離子內流是心肌興奮-收縮耦聯的特征。心臟類器官具有類似竇房結的起搏位點,驅動整個三維球體的收縮。X射線輻射后,電子顯微鏡下觀察到肌原纖維變化,促使我們檢測心臟類器官的鈣信號。通過高分辨熒光標測技術評估心臟類器官的鈣瞬變(calcium transients)變化,研究鈣信號活動的速度、離散度、振幅、頻率及復極時間等指標的改變。結果表明,UCMSCs-sEVs治療逆轉了輻射損傷導致的鈣處理異常事件。
鈣離子內流是心肌興奮-收縮耦聯的特征。心臟類器官具有類似竇房結的起搏位點,驅動整個三維球體的收縮。X射線輻射后,電子顯微鏡下觀察到肌原纖維變化,促使我們檢測心臟類器官的鈣信號。通過高分辨熒光標測技術評估心臟類器官的鈣瞬變(calcium transients)變化,研究鈣信號活動的速度、離散度、振幅、頻率及復極時間等指標的改變。結果表明,UCMSCs-sEVs治療逆轉了輻射損傷導致的鈣處理異常事件。

圖6 UCMSCs-sEVs恢復了輻射損傷的心臟類器官的正常鈣瞬變
7. UCMSCs-sEVs減輕了輻射誘導的小鼠心臟損傷
本研究構建了放射性心臟損傷的小鼠模型,研究發現輻射后第14天,小鼠多種心肌酶濃度升高(LDH1 持續升高),UCMSCs-sEVs治療顯著改善心肌酶譜。心功能檢測顯示,輻射導致左心室射血分數(LVEF)和縮短分數(LVFS)下降,治療后明顯回升。超微結構觀察表明,該治療減輕了輻射引起的線粒體嵴減少、肌原纖維排列紊亂及膠原沉積。RT-qPCR結果顯示,輻射誘導促炎因子(IL-1α/β、IL-6、TNF-α)和纖維化因子(TGF-β、α-SMA、I/III 型膠原)表達升高,抗炎因子IL-10降低,而UCMSCs-sEVs治療逆轉了上述異常。心臟類器官中炎癥和纖維化相關基因的表達與在小鼠心臟中觀察到的結果一致。
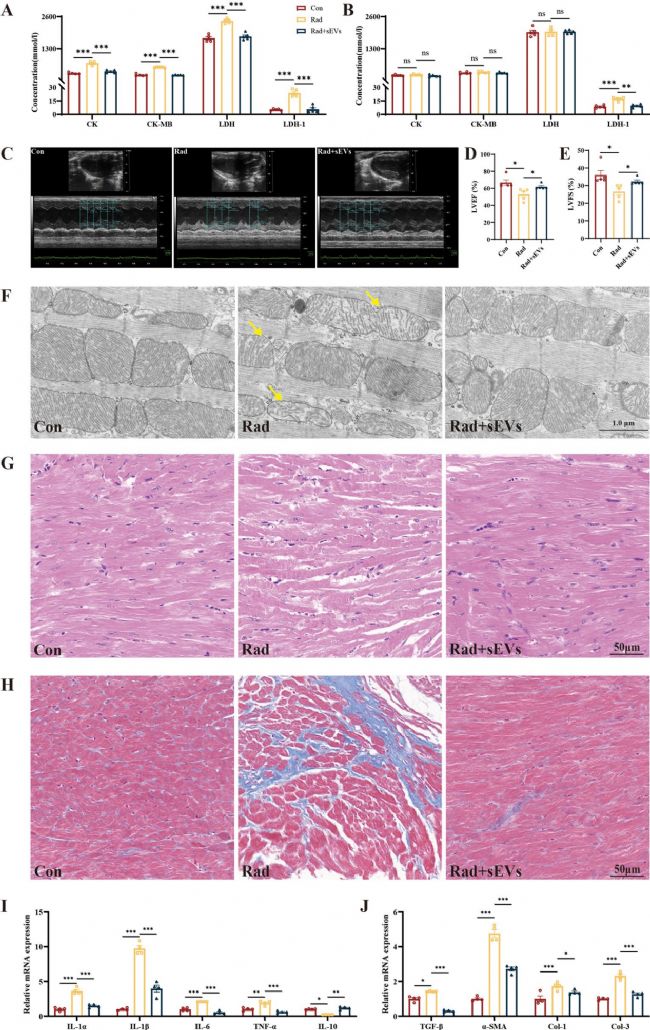
圖7 UCMSCs-sEVs對輻射誘導的小鼠心臟損傷的治療作用
8. 與氧化磷酸化通路和P53信號通路相互作用的銅代謝異常可能是輻射誘導的心臟類器官損傷的關鍵
為探究輻射損傷及UCMSCs-sEVs治療機制,對心臟類器官進行RNA-seq分析,發現835個差異表達基因(DEGs),富集到p53信號通路。UCMSCs-sEVs通過調控p53信號、修復氧化磷酸化及相關通路,逆轉輻射誘導的基因表達異常,為放射性心臟損傷治療提供分子機制證據。
為探究輻射損傷及UCMSCs-sEVs治療機制,對心臟類器官進行RNA-seq分析,發現835個差異表達基因(DEGs),富集到p53信號通路。UCMSCs-sEVs通過調控p53信號、修復氧化磷酸化及相關通路,逆轉輻射誘導的基因表達異常,為放射性心臟損傷治療提供分子機制證據。

圖8 UCMSCs-sEVs在輻射誘導的心臟類器官損傷中的潛在作用機制
結論:
本研究利用UCMSCs-sEVs治療放射性心臟類器官損傷(RICoI),對線粒體結構和功能以及電信號傳導的觀察,發現其對RICoI具有顯著治療效果。這種治療作用可能歸因于p53信號通路、氧化磷酸化信號通路及銅離子積累的協同效應。該研究首次報道輻射可誘導心臟類器官發生銅死亡(cuproptosis),并證實UCMSCs-sEVs能夠緩解RICoI及放射性缺血性心臟病(RIHD)。這些發現不僅有助于理解放射性心臟損傷,也為RIHD的治療提供了新策略。
本研究利用UCMSCs-sEVs治療放射性心臟類器官損傷(RICoI),對線粒體結構和功能以及電信號傳導的觀察,發現其對RICoI具有顯著治療效果。這種治療作用可能歸因于p53信號通路、氧化磷酸化信號通路及銅離子積累的協同效應。該研究首次報道輻射可誘導心臟類器官發生銅死亡(cuproptosis),并證實UCMSCs-sEVs能夠緩解RICoI及放射性缺血性心臟病(RIHD)。這些發現不僅有助于理解放射性心臟損傷,也為RIHD的治療提供了新策略。
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





