PCL-PVAc-PEG在活性物遞送和生物材料上的應用優勢
在生物材料和活性物遞送等研究領域,材料科學的發展不斷為科研人員提供新的思路和工具。PCL-PVAc-PEG(聚乙烯己內酰胺-聚醋酸乙烯酯-聚乙二醇接枝共聚物,M43956,AbMole),憑借其獨特的優勢,包括可生物降解性、高包封率、靶向運輸、可控釋放及可修飾的特性,在生命科學和微納醫學等研究領域中扮演著重要的角色。AbMole為全球科研客戶提供高純度、高生物活性的抑制劑、細胞因子、人源單抗、天然產物、熒光染料、多肽、靶點蛋白、化合物庫、抗生素等試劑,全球大量文獻專利引用。
一、PCL-PVAc-PEG:多性能融合的材料平臺
PCL-PVAc-PEG(M43956,AbMole)是PCL、PVAc與聚PEG的 “智慧結晶”。PCL 具備良好的生物相容性與可降解性,在生物材料領域備受青睞;PVAc 則賦予材料出色的粘附性與成膜性;而 PEG 憑借高度的親水性與靈活的鏈段結構,能有效改善材料的溶解性與柔韌性并提高生物相容性。三者結合,形成了一種性能互補、功能多樣的 “超級材料”。
二、PCL-PVAc-PEG:活性物遞送與生物材料的多場景應用
PCL-PVAc-PEG(M43956,AbMole)材料的多功能性使其在活性物遞送和生物材料研究中展現出廣泛的應用前景。它可以根據不同的研究需求,被制成納米粒、微球、支架等多種形式,滿足多樣化的實驗目標[1-3]。2014年,AbMole的兩款抑制劑分別被西班牙國家心血管研究中心和美國哥倫比亞大學用于動物體內實驗,相關科研成果發表于頂刊 Nature 和 Nature Medicine。
1. 生物活性物質遞送:精準的載藥與釋放
PCL-PVAc-PEG(M43956,AbMole)在活性物遞送領域的應用主要體現在其能夠高效負載各類生物活性物質(如包裹小分子抑制劑/激動劑、蛋白質和核酸等),并實現精準的釋放。還可通過調節材料的組成和結構,實現負載對象的緩慢釋放,延長活性物的作用時間。在研究中,PCL-PVAc-PEG納米粒可以用于負載抗癌抑制劑或生物活性肽。通過控制納米顆粒的粒徑和表面修飾,能夠實現活性物在目標部位的富集,提高它們的利用效率。此外,PEG的親水性還能夠減少納米粒子在生物體系中的非特異性吸附,進一步提高遞送效率。例如PCL-PVAc-PEG負載Docetaxel后形成的納米膠束可以有效抑制膠質瘤細胞U251-MG、U87-MG在體外和動物體內的增殖[4]。
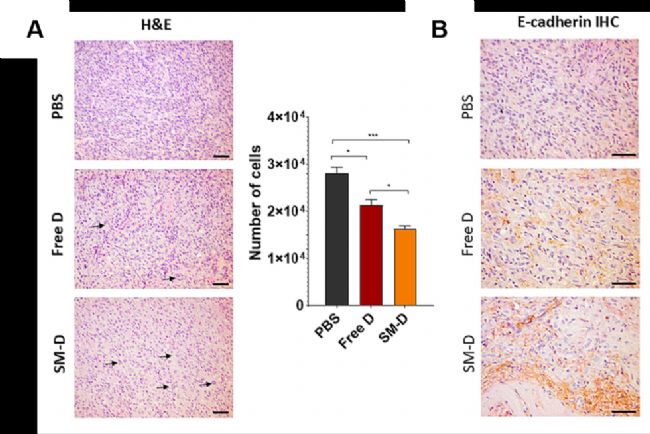
圖1. In vivo safety and efficacy study of U78-MG tumor-bearing mice treated with vehicle (PBS), Docetaxel (B), and Docetaxel-loaded micelles [4]
2. 細胞培養和組織工程:構建理想的支架材料
在細胞培養和組織工程研究中,PCL-PVAc-PEG(M43956,AbMole)材料同樣表現出色。它可以被制成多孔支架,用于模擬天然組織的微環境,支持細胞的黏附、增殖和分化。PCL的可降解性和PVAc的特殊的力學性能為支架提供了穩定的支撐,而PEG的親水性則有助于細胞的黏附和生長。例如,在骨組織工程研究中,PCL-PVAc-PEG支架能夠促進骨細胞的生長和礦化。其多孔結構為細胞提供了充足的生長空間,同時材料的降解產物能夠為細胞提供營養,促進新組織的形成。在軟組織工程中,PCL-PVAc-PEG支架也能夠有效支持細胞的生長和組織的再生,為相關研究提供了有力的工具。例如在培養基中加入PCL-PVAc-PEG可以增強人類造血干細胞在體外的擴增速率,并在加入某些抑制后,可實現不依賴細胞因子的造血干細胞培養[5]。
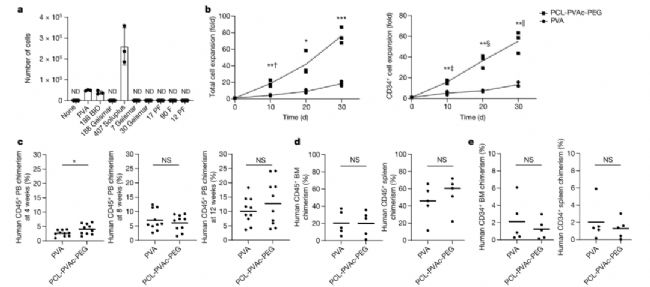
圖2. Caprolactam-polymer-based 3a medium supports the efficient expansion of human HSCs ex vivo[5]
PCL-PVAc-PEG(聚乙烯己內酰胺-聚醋酸乙烯酯-聚乙二醇接枝共聚物(M43956,AbMole)的出現為生物材料和活性物遞送研究帶來了新的思路和工具。它通過融合PCL、PVAc和PEG的優良特性,為研究者提供了一個多功能的平臺,能夠滿足從活性物遞送到組織工程的多種應用需求。AbMole憑借其高品質的產品和專業的服務,正在成為眾多科研人員的首選合作伙伴。AbMole是ChemBridge中國區官方指定合作伙伴。
參考文獻
[1] ZHU C, GONG S, DING J, et al. Supersaturated polymeric micelles for oral silybin delivery: the role of the Soluplus-PVPVA complex [J]. Acta pharmaceutica Sinica B, 2019, 9(1): 107-17.
[2] XUE X, HU Y, WANG S, et al. Fabrication of physical and chemical crosslinked hydrogels for bone tissue engineering [J]. Bioactive materials, 2022, 12: 327-39.
[3] LIU P, ZHOU J Y, CHANG J H, et al. Soluplus-Mediated Diosgenin Amorphous Solid Dispersion with High Solubility and High Stability: Development, Characterization and Oral Bioavailability [J]. Drug design, development and therapy, 2020, 14: 2959-75.
[4] GERMAN-CORTéS J, HERRERO R, TORROGLOSA N, et al. Preclinical evaluation of several polymeric micelles identifies Soluplus®-docetaxel as the most effective candidate in multiple glioblastoma models [J]. Journal of Controlled Release, 2025, 381: 113616.
[5] SAKURAI M, ISHITSUKA K, ITO R, et al. Chemically defined cytokine-free expansion of human haematopoietic stem cells [J]. Nature, 2023, 615(7950): 127-33
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





