文獻解讀:胃癌患者免疫細胞的單細胞轉錄組測序

期刊: Aging 5.59
測序技術:單細胞轉錄組測序
導語
胃癌預后相對較差。單細胞轉錄組測序能夠在單細胞水平上對高度復雜的腫瘤微環境中的細胞群體進行特異性分析,從而揭示了未表征的分子復雜性。在這項研究中,使用單細胞轉錄組測序在單細胞水平上表征了從胃癌患者分離的T細胞的異質性。鑒定了不同的免疫細胞亞型及其異質轉錄因子,并描繪了它們的發育軌跡。特別是對CD8+細胞和Tregs,相較于對照組,來自胃癌組織的CD8+腫瘤浸潤淋巴細胞(TIL)中的IRF8轉錄因子下調。針對CD8+耗竭型T細胞和Treg細胞進行的多種分析為胃癌的免疫治療提供理論基礎。
方法
根據單細胞轉錄組測序數據胃癌患者中分離的T細胞異質性,確定了不同的免疫細胞亞型及其異質轉錄因子,并對不同細胞亞群中的不同基因進行分析,為胃癌中免疫細胞的靶向治療提供理論基礎。
結果結論
借助單細胞測序對胃癌組織,胃癌患者外周血的免疫細胞以及對照組免疫細胞進行測序,使用UMAP法降維可視化后,根據特異表達基因將細胞注釋為特定的免疫細胞。之后針對不同的免疫細胞進行差異基因的分析,功能通路分析以及特定基因的分析。這些發現為胃癌靶向免疫治療提供了理論基礎,可作為研究免疫細胞基本特征并潛在指導免疫治療。
研究結果
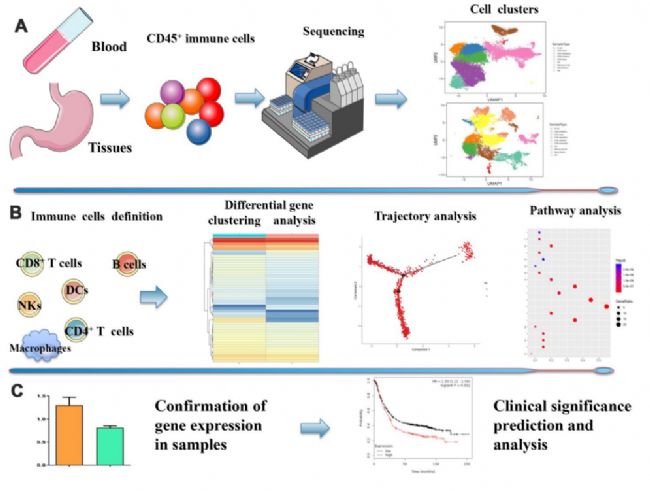
1. 從胃癌樣品和免疫細胞聚類中獲取scRNA-seq圖譜
從9個樣本中分離的免疫細胞進行了scRNA-seq,其中包括兩個健康人的兩個外周血樣本、三個胃癌患者術前的三個外周血樣本,以及兩對胃癌組織和癌旁組織樣本。根據細胞的分子和功能特點對其進行分類,確定了組織中的10個細胞簇和外周血中的9個細胞簇(圖1A)。接下來,確定了每個免疫細胞亞型及其異質轉錄因子。圖1B顯示了它們的發展軌跡(圖1B)。同時確認了一些基因的表達,并分析了其與臨床特征的相關性(圖1C)
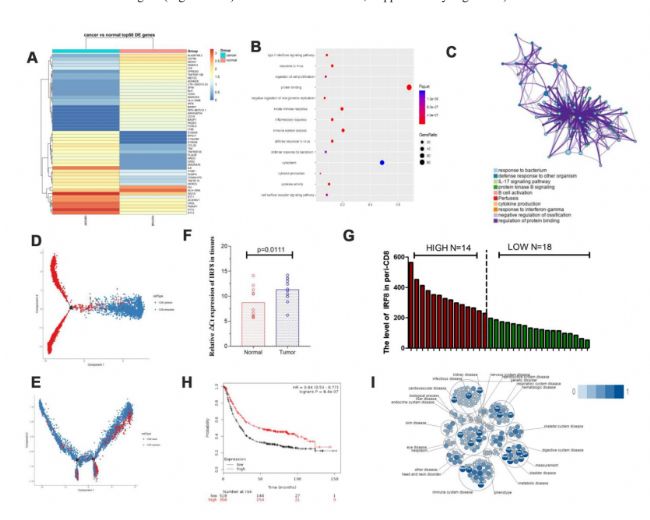
2.與正常樣品相比,胃癌樣品中耗竭型CD8+T細胞中的IRF8下調
為揭示CD8+T細胞的內在結構和潛在功能亞型,包括初始型,細胞毒性型和耗竭型CD8+T細胞,我們分別分析了T與N組和PB與HB組中的基因,并制作了熱圖和火山圖(圖2A、2B)。重點分析了耗竭型CD8+T細胞在胃癌中的優先富集。途徑分析表明,腫瘤浸潤耗竭型CD8+T細胞中的這些不同基因可能參與細胞因子的產生(圖2C)。在軌跡分支方面,我們觀察到它始于細胞毒性CD8+T細胞,結束于胃癌組織中耗竭型CD8+T淋巴細胞(圖2D),最后以耗竭型CD8+T細胞在血液中結束(圖2E),這與腫瘤的正常過程一致。我們評估了來自11個胃癌患者腫瘤的腫瘤浸潤CD8+耗竭T細胞和CD8+TIL中干擾素調節因子8(IRF8)轉錄因子的表達,發現與正常組織相比,IRF8在兩種組織中均下調(圖2F)。此外,在最初診斷時分析了32名胃癌患者的外周血單核細胞(PBMC),以使用流式細胞術評估CD8+T細胞中的IRF8表達(圖2G)。根據癌癥基因組圖譜(TCGA)的胃癌數據,IRF8下調與總生存期(OS)縮短相關(圖2H)。Open Targets軟件顯示,IRF8在免疫系統的細胞中發揮負調節作用(圖2I)。
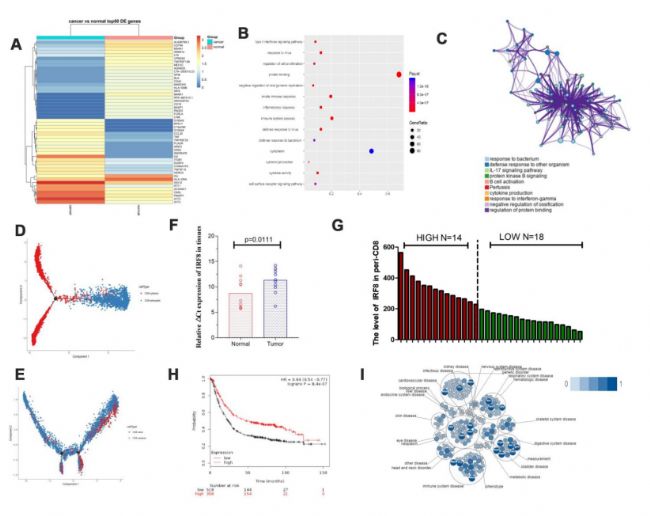
3. 胃癌中與Treg功能唯一相關的基因的鑒定
IFIT2、CCL3、RBPJ等上調,而IGJ、XCL1、XCL2等下調(圖3A)。途徑表明它們富含細胞因子-細胞因子-受體相互作用、PI3K-AKT和NF-kB途徑(圖3B,3C)。對于軌跡分支,我們在腫瘤環境中觀察到更少的效應器Treg,但在胃癌組織中觀察到更明顯的初始型(圖3D)。我們強調了胃癌中差異表達的一些膜受體、轉錄因子和細胞因子。轉錄因子RBPJ在腫瘤浸潤Tregs中過度表達(圖3E)。使用S在腫瘤浸潤Tregs中,我們發現與相鄰正常組織相比,胃癌組織中TRING的交互網絡分析顯示,RBPJ參與了NOTCH途徑(圖3F)。為了探索可能調節RBPJ表達的潛在網絡,我們分析了可能促進或抑制RBPJ基因轉錄的TFs。我們使用Cistrome DB Toolkit發現前20個TF在癌癥組織中差異表達(圖3H)。我們發現RBPJ可能是促進胃癌中LAG3和GEPIA2表達的TF(圖3I)。
4. B細胞的基因標記和胃癌中的通路分析
癌組織和癌旁組織B細胞亞群中差異表達的基因由EIF1AY、KRT19、LCN2、RPS4Y1等組成(圖4A)。在PB與HB組中,RORA、COL6A2、ETS1、FHIT等高表達,而HBA2、HBA1、IGLL5、C1CB等下調(圖4B)。分析顯示,B細胞亞群中上調的基因分散在TNF、NOD樣和CXCR趨化因子受體結合途徑中(圖4C,4D)。熱圖分析結果表明,B細胞通過產生細胞因子(包括IFNG、CCL3、IL-8等)發揮免疫調節功能。
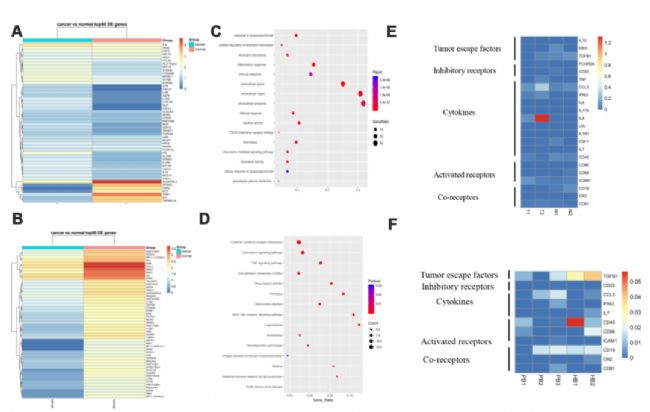
5. NK細胞對胃癌反應時分泌的更多的抑制性受體和更少的激活性受體
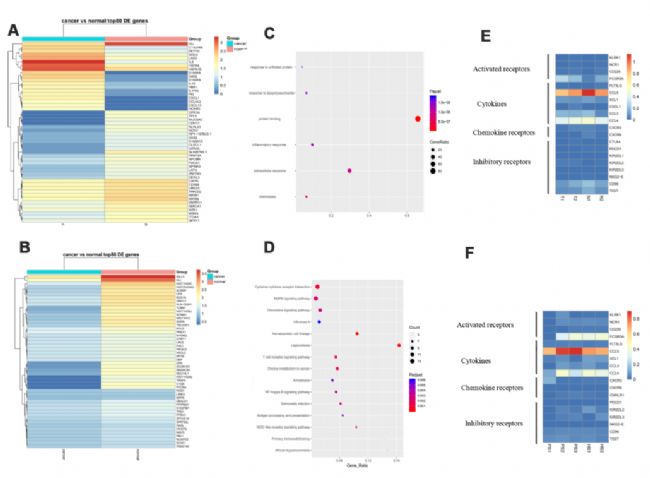
NK細胞是先天免疫的重要組成部分,由于其釋放細胞因子的能力和介導對腫瘤細胞的細胞溶解活性,在宿主防御中發揮關鍵作用。與相鄰正常組織相比,胃癌組織中IL8、G0S2、HSPA6、CXCL1等上調,而IGJ、TFF1、NCR2等下調(圖5A)。在PB與HB組中,SCAF1、LAG3、TPM1等高表達(圖5B)。途徑分析表明,這些基因可能參與細胞因子-細胞因子-受體相互作用、MAPK信號傳導、趨化因子信號傳導和T細胞受體信號傳導(圖5C,5D)。與對照組相比,NK細胞在胃癌組織中表達了更多的抑制性受體,如KIR2DL2。同樣,與對照組相比,NK細胞在胃癌患者血液中表達較少的活化受體,如KLRK1和CD226。最后,NK細胞在胃癌中分泌更多的細胞因子,包括CCL3和CCL4(圖5E,5F)。這些數據表明NK細胞積極參與免疫監測以預防胃癌。
參考文獻:
Single-cell RNA sequencing of immune cells in gastric cancer patients 2020; 12(3): 2747-2763. doi: 10.18632/aging.102774.





